
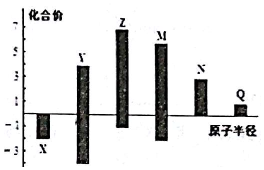
| A. | 金属性:N>Q | |
| B. | 最高价氧化物对应水化物酸性:M>Y>N | |
| C. | 简单离子半径:Q>N>X | |
| D. | 原子序数:Z>M>X>Y |
分析 X、Y、Z、M、N、Q皆为短周期主族元素,由图中化合价可知,X的化合价为-2价,没有正化合价,故X为O元素,M的化合价为+6、-2价,故M为S元素;Z的最高正价为+7价、最低价-1,则Z为Cl元素;Y的化合价为+4、-4价,原子半径小于Cl,故Y为C元素;N为+3价,原子半径大于S,故N为Al元素;Q的化合价为+1价,处于IA族,原子半径大于Al元素,故Q为Na元素,据此进行解答.
解答 解:X、Y、Z、M、N、Q皆为短周期主族元素,由图中化合价可知,X的化合价为-2价,没有正化合价,故X为O元素,M的化合价为+6、-2价,故M为S元素;Z的最高正价为+7价、最低价-1,则Z为Cl元素;Y的化合价为+4、-4价,原子半径小于Cl,故Y为C元素;N为+3价,原子半径大于S,故N为Al元素;Q的化合价为+1价,处于IA族,原子半径大于Al元素,故Q为Na元素,
A.同周期自左而右金属性减弱,故金属性Na>Al,故A错误;
B.非金属性越强,最高价氧化物对应水化物的酸性越强,故酸性高氯酸>硫酸>偏铝酸,故B正确;
C.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->Na+>Al3+,故C错误;
D.根据分析可知原子序数大小为:Z(Cl)>M(S)>X(O)>Y(C),故D正确;
故选BD.
点评 本题考查结构性质与位置关系等,题目难度中等,根据化合价与原子半径推断元素是解题的关键,注意对元素周期律的理解掌握.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C4H10O的同分异构体有4种 | |
| B. | 可用溴水鉴別苯、四氯化碳和酒精 | |
| C. | 石油分馏后可获得乙烯、丙烯和丁二烯 | |
| D. | 乙二酸与乙二醇生生成聚乙二酸乙二酯的反应属于加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硒(Se)化氢比硫化氢稳定 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 铍(Be)的原子失电子能力比镁弱 | |
| D. | 氢氧化锶[Sr(OH)2]比氢氧化钙的碱性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铵盐都易溶于水 | |
| B. | 铵盐受热分解都能得到氨气 | |
| C. | 除去NH4Cl溶液中少量的CaCl2,加过量的NH4HCO3溶液后过滤 | |
| D. | 铵盐与碱液共热都能生成使蓝色石蕊试变红的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
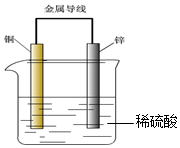
| A. | 锌是负极,随着放电的进行其质量逐渐减轻 | |
| B. | 放电过程中氢离子移向铜极,硫酸根离子移向锌极 | |
| C. | 电流从锌极经导线流向铜极 | |
| D. | 锌极上发生的是氧化反应,铜极上发生的是还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com