
X、Y、Z是三种常见元素的单质,甲乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是
A.X、Y、Z都是非金属单质
B.如果X、Y都为非金属单质,则Z必为金属单质
C.如果X、Y都为金属单质,则Z必为非金属单质
D.X、Y、Z中至少有一种是金属单质
科目:高中化学 来源: 题型:
Na2CO3的制取方法及综合实验探究
(1)我国化学家侯德榜改革国外的纯碱生产工艺,其生产流程可简要表示如下:

①往饱和食盐水中依次通入足量的NH3、CO2(氨碱法),而不先通CO2再通NH3的原因是_______________________________________________________________________
________________________________________________________________________。
②从生产流程图可知,可循环利用的物质是__________。
③写出沉淀池中、煅烧炉中反应的化学方程式__________________________________
________________________________________________________________________。
(2)如何用CO2和50 mL 2 mol·L-1 NaOH溶液制取50 mL 1 mol·L-1 Na2CO3溶液?
①写出简要的实验步骤:_________________________________________________________________________________________________________________________。
②写出有关反应的化学方程式:____________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色混合气体可能由NH3、NO、CO2、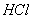 、O2中的二种或几种组成。室温下50mL的混合气体通过足量的浓硫酸,体积减少至40mL,再通过足量的NaOH溶液,体积减少到20 mL,余下的气体接触空气后立即变色。试推断:
、O2中的二种或几种组成。室温下50mL的混合气体通过足量的浓硫酸,体积减少至40mL,再通过足量的NaOH溶液,体积减少到20 mL,余下的气体接触空气后立即变色。试推断:
(1)余气接触空气变色的化学方程式为 ;
(2)原混合气体中一定含有 气体;
(3)混合气体在同温、同压下的体积比为 (按气体顺序)
(4)原混合气体中一定不含 气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
以乙醇为原料,用下述6种类型的反应:①氧化,②消去,③加成,④酯化,⑤水解,⑥加聚,来合成乙二酸乙二酯()的正确顺序是( )
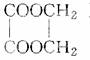 A.①⑤②③④ B.①②③④⑤
A.①⑤②③④ B.①②③④⑤
C.②③⑤①④ D.②③⑤①⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
酯化反应是中学有机化学反应中重要的反应之一。如图为乙酸乙酯的制备装置图。a试管中装有适当过量的无水乙醇、2mL浓硫酸和2mL冰醋酸,小心均匀加热(避免副反应)至充分反应。请回答:

(1)写出反应的化学方程式
;
(2)b试管中装的液体通常是 ,实验时往往在b试 管中可以看到少量气泡,写出与此现象对应的离子方程式 。
(3)甲同学为了研究该反应机理使用了2H作同位素示踪原子。你认为合理吗?为什么? ;
乙同学采用“CH3CH218OH”做该实验,结果含18O原子的产物的结构简式为 ,乙酸分子中被取代的原子团的电子式为 ;
(4)浓硫酸在该反应中的作用是催化剂和 剂,以此加快反应速率和 。(用化学平衡知识答题)
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)具有很强的氧化性,是一种新型的高效水处理剂。
(1)高铁酸钾具有强氧化性的原因是 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为 ,___ _____。
(3)制备K2FeO4可以采用干式氧化法或湿式氧化法。
① 干式氧化的初始反应是2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中每生成2 mol Na2FeO4时转移电子 mol。
② 湿式氧化法的流程如下图:
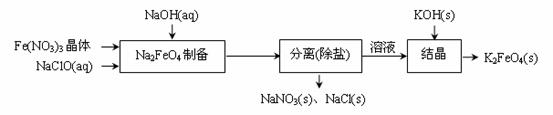
上述流程中制备Na2FeO4的化学方程式是 。
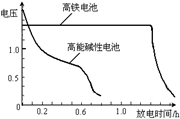
(4)高铁电池是正在研制中的可充电电池,右图为该电池和常用的高能
碱性电池的放电曲线,由此可得出的高铁电池的优点有 、
。
(5)探究高铁酸钾的某种性质。
【实验1】将适量K2FeO4固体分别溶解于pH 为 4.74、7.00、11.50 的水溶液中,配得FeO42-浓度为 1.0 mmol·L-1(1 mmol·L—1 =10—3 mol·L—1)的试样,静置,考察不同初始 pH 的水溶液对K2FeO4某种性质的影响,结果见图1(注:800 min后,三种溶液中高铁酸钾的浓度不再改变)。
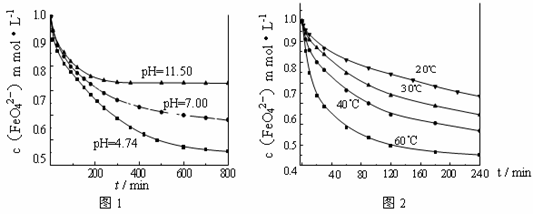
【实验2】将适量 K2FeO4 溶解于pH=4.74 的水溶液中,配制成FeO42-浓度为
1.0 mmol·L-1 的试样,将试样分别置于 20℃、30℃、40℃和60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。则
①实验1的目的是 ;
②实验2可得出的结论是 ;
③高铁酸钾在水中的反应为4 FeO42—+10 H2O 4 Fe(OH)3 +8OH—+3 O2↑。 由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是
4 Fe(OH)3 +8OH—+3 O2↑。 由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是
。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)____ClO-+____Fe(OH)3+____===____Cl-+____FeO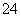 +____H2O
+____H2O
(2)____MnO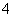 +____H2O2+____===____Mn2++____O2↑+____H2O
+____H2O2+____===____Mn2++____O2↑+____H2O
(3)某高温还原法制备新型陶瓷氮化铝(AlN)的反应体系中的物质有:Al2O3、C、N2、AlN、CO。
请将AlN之外的反应物与生成物分别填入以下空格内,并配平。
 +
+ +
+ ―→
―→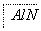 +
+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关反应SiO2+3C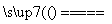 SiC+2CO↑的叙述中,正确的是 ( )
SiC+2CO↑的叙述中,正确的是 ( )
A.氧化剂是SiO2
B.氧化剂与还原剂的物质的量之比为1∶2
C.碳在反应中只作还原剂
D.若生成1 mol SiC,则转移电子2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。以卤块为原料可制得轻质氧化镁,工艺流程如下图:
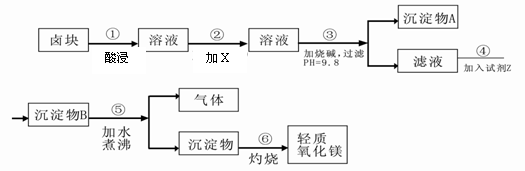
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH 表2 化学试剂价格表
| 试剂 | 价格(元/吨) |
| 漂液(含NaClO,25.2%) | 450 |
| 双氧水(含H2O2 ,30%) | 2400 |
| 烧碱(含98% NaOH) | 2100 |
| 纯碱(含99.5% Na2CO3) | 600 |
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com