
(10分)Ⅰ.(1分Ⅰ)除去气态原子中的一个电子使之成为气态+1价阳离子时所需外界提供的能量叫做该元素的第一电离能。下图是周期表中短周期的一部分,其中第一电离能最小的元素是_______. ( 填字母)
Ⅱ.(6分)德国和美国科学家首先制出由20个碳原子组成的
空心笼状分子C20,该笼状结构是由许多正五边形构成(如图)。请回答:
C20分子共有_______个正五边形,共有_______条棱边,C20晶体属于_______ (填晶体类型).
Ⅲ. (3分)晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl晶体结构如图所示。
(1)晶体中每个Na+同时吸引着______个Cl-,每个Cl-同时吸引着_______个Na+。
(2)晶体中在每个Cl-周围与它最接近且距离相等
的Cl-共有________个。
Ⅰ.C(1分) ;Ⅱ.12. (2分)30(2分);分子晶体(2分)。
Ⅲ.6(1分) ;6(1分) ;12(1分)
解析:Ⅰ.金属性越强,第一电离能越小。根据元素周期律可知C的金属性最强,所以第一电离能最小。
Ⅱ.根据结构图可知,每个碳原子形成3个C-C键,1个C-C键由2个电子形成,所以含有的棱边是![]() 。每个棱边被2个相邻的正五边形共用,所以平均每个正五边形拥有2.5个棱边,因此正五边形的个数是
。每个棱边被2个相邻的正五边形共用,所以平均每个正五边形拥有2.5个棱边,因此正五边形的个数是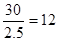 。该化合物中含有分子,属于分子晶体。
。该化合物中含有分子,属于分子晶体。
Ⅲ.根据晶胞的结构示意图可知每个钠离子同时吸引着6个氯离子,即上下、左右、前后各1个。反过来,每各氯离子同时吸引着6各钠离子。根据示意图可知晶体中在每个Cl-周围与它最接近且距离相等的Cl-位于面的中心处,共3各。由于每个顶点可以形成8各立方体,所以个数是。


科目:高中化学 来源:2011-2012学年河北省保定三中高二下学期期中考试化学试卷(带解析) 题型:填空题
(共10分) G 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
(1)A与银氨溶液反应有银镜生成,则A的分子式是________。(1分)
(2)B―→ C的反应类型是________。(1分)
(3)C与E反应生成F的化学方程式________________________________(2分)
(4)F的一种同分异构体能水解且苯环上的一氯代物有一种,任意写出其中一种的结构简式________。(2分)
(5)写出F和过量NaOH溶液共热时反应的化学方程式:
__________________________________________________________。(2分)
(6)下列关于G的说法正确的是________。(2分)
a.能与金属钠反应
b.1 mol G最多能和5 mol氢气反应
c.分子式是C9H6O3
d.1molG最多和3molNaOH反应
查看答案和解析>>
科目:高中化学 来源:2012年鲁科版高中化学选修5 1.1有机化合物的结构与性质 烃练习卷(解析版) 题型:实验题
实验题(本题共10分)
(1)现有三组混合液:①乙酸乙酯和乙酸钠溶液 ②乙醇和水 ⑧溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是 ( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
(2)某化学课外小组用海带为原料制取了少量碘水.现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液.其实验操作可分解为如下几步:
(A)把50毫升碘水和15毫升CCl4加入分液漏斗中,并盖好玻璃塞;(B)把盛有溶液的分液漏斗放在铁架台的铁圈中;(C)倒置漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;(D)检验分液漏斗活塞和上口的玻璃塞是否漏液;(E)旋开活塞,用烧怀接收溶液;(G)静置,分层(F)将分液漏斗上口倒出上层水溶液;(H)将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔;就此实验。完成下列填空:
①正确操作步骤的顺序是:(用上述各操的编号字母填写)
___→___→___→ → →____→ →
②上述(E)步骤的操作中应注意 ;上述(H)步骤操作的目的是 。
③能选用CCl4从碘水中萃取碘的原因是 。
④下列物质,不能作为从溴水中萃取溴的溶剂的是 。
A.热裂汽油 B.苯 C.酒精 D.正庚烷
查看答案和解析>>
科目:高中化学 来源:2013届河北省高二下学期期中考试化学试卷(解析版) 题型:填空题
(共10分) G 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:

(1)A与银氨溶液反应有银镜生成,则A的分子式是________。(1分)
(2)B―→ C的反应类型是________。(1分)
(3)C与E反应生成F的化学方程式________________________________(2分)
(4)F的一种同分异构体能水解且苯环上的一氯代物有一种,任意写出其中一种的结构简式________。(2分)
(5)写出F和过量NaOH溶液共热时反应的化学方程式:
__________________________________________________________。(2分)
(6)下列关于G的说法正确的是________。(2分)
a.能与金属钠反应
b.1 mol G最多能和5 mol氢气反应
c.分子式是C9H6O3
d.1molG最多和3molNaOH反应
查看答案和解析>>
科目:高中化学 来源:2010年浙江省杭州地区七校联考高二第二学期期中化学试卷 题型:实验题
(10分)实验小组测定某肥料中的总氮含量(以氮的质量分数表示) ,实验装置如下图(图中加热及夹持仪器略去):

称取1.200 g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在碱性溶液中蒸馏氨,用25.00 mL浓度为0.5000 mol/L-1硫酸溶液充分吸收,再用浓度为0.1000 mol/L-1氢氧化钠溶液滴定未反应的硫酸。重复上述实验三次。实验数据如下:
|
实验次数 |
氢氧化钠溶液的体积 |
|
|
滴定前刻度(mL) |
滴定后刻度(mL) |
|
|
1 |
0.00 |
5. 01 |
|
2 |
6.00 |
10.99 |
|
3 |
12.00 |
17.60 |
(1)写出圆底烧瓶内发生反应的离子方程式 。
(2)分液漏斗和圆底烧瓶之间的导管a的作用是 ; b的作用是
;冷凝管中从(填“n”或“m”) 口进水。
(3)在滴定过程中,以下操作会使所测总氮含量偏小的是(填序号) 。
A.锥形瓶水洗后未烘干 B.滴定过程中滴定管有漏水现象
C.滴定过程中有少量溶液从锥形瓶中溅出 D.滴定前滴定管内有气泡,滴定后没有了
(4)若实验操作均正确,但测定结果偏低,可能造成该结果的主要原因是 。
(5)利用题目中所给数据计算肥料中总氮含量为 %(计算结果保留到小数点后1位)。
查看答案和解析>>
科目:高中化学 来源:09-10年北京市朝阳区高一下学期期末考试化学卷 题型:填空题
(10分)海水中化学资源的综合开发利用已受到各国的高度重视。Br2和Mg等两种单质都可以从海水中提取,下图为提取它们的步骤:

请回答:
I.从海水中提取的溴占世界年产量的1/3,主要方法就是上述流程中的空气吹出法。
(1)制取Br2时,第一次通入Cl2发生反应的离子方程式是__________________。
(2)吸收塔中反应的离子方程式是________________________________________。
由(1)、(2)可知,SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是
__________________。( 用“”表示)
II.镁及其合金是用途很广泛的金属材料,而目前世界上60%的镁就是从海水中按上述流程提取的。
(1)上述流程中为了使MgSO4完全转化为Mg(OH)2,试剂①可以选用___________(写化学式)。
(2)加入试剂②后反应泊离子方程式是_________________________________。
(3)步骤①包括加热、蒸发、冷却、结晶、_________。
(4)通电时无水MgCl2在熔融状态下反应的化学方程式是
___________________________________________________。
III.上述流程在生产溴和镁的同时还可以制得其他化工物质,比如制备耐火材料氧化镁和盐酸。生产方法是:
①将氯化镁晶体(MgCl2·6H2O)加热到523OC以上,该晶体可以分解得到耐火材料氧化镁和两种气态化合物,其中一种气体常温下为无色液体。
②将两种气体冷却到室温,再根据需要,加入不同量的水,就可得到不同浓度的盐酸。
(1)MgCl2·6H2O在523OC以上分解的化学方程式是_____________________________。
(2)现用1mol MgCl2·6H2O分解所得的非固体产物来制取密度为1.19g/cm3的盐酸溶液168mL,需加水__________g(精确到0.1),该盐酸中溶质的物质的量浓度是____________mol/L(精确到0.1)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com