已知:①将煤转化为水煤气的主要化学反应为C(s)+H
2O(g)
CO(g)+H
2(g);
②C(s)、CO(g)和H
2(g)完全燃烧的热化学方程式分别为:
C(s)+O
2(g)═CO
2(g);△H=-393.5kJ?mol
-1H
2(g)+
O
2(g)═H
2O(g);△H=-242.0kJ?mol
-1CO(g)+
O
2═CO
2(g);△H=-283.0kJ?mol
-1请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:
C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5 kJ?mol-1
C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5 kJ?mol-1
.
(2)比较反应热数据可知,1mol CO(g)和1mol H
2(g)完全燃烧放出的热量之和比1mol C(s)完全燃烧放出的热量多.甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出下列循环图:
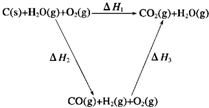
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”.
请分析:甲、乙两同学观点正确的是
乙
乙
(填“甲”或“乙”);判断的理由是
甲同学忽略了煤转化为水煤气要吸收热量
甲同学忽略了煤转化为水煤气要吸收热量
.
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点
①减少污染 ②燃烧充分
①减少污染 ②燃烧充分
.
(4)已知热化学方程式:
Mg(OH)
2(s)=MgO(s)+H
2O(g)△H
1=+81.5kJ?mol
-1Al(OH)
3(s)=
Al
2O
3(s)+
H
2O(g)△H
2=+87.7kJ?mol
-1①Mg(OH)
2和Al(OH)
3起阻燃作用的主要原因是
Mg(OH)2和Al(OH)3受热分解时吸收大量的热,使环境温度下降;同时生成的耐高温、稳定性好的MgO、Al2O3覆盖在可燃物表面,阻燃效果更佳
Mg(OH)2和Al(OH)3受热分解时吸收大量的热,使环境温度下降;同时生成的耐高温、稳定性好的MgO、Al2O3覆盖在可燃物表面,阻燃效果更佳
.
②等质量Mg(OH)
2和Al(OH)
3相比,阻燃效果较好的是
Mg(OH)2
Mg(OH)2
,原因是
等质量的Mg(OH)2比Al(OH)3吸热多
等质量的Mg(OH)2比Al(OH)3吸热多
.

 名校课堂系列答案
名校课堂系列答案 某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1min时到达平衡,依图所示:
某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1min时到达平衡,依图所示: 3Y+Z
3Y+Z 3Y+Z
3Y+Z