
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| △H1-△H2 |
| 2 |
| △H1-△H2 |
| 2 |


科目:高中化学 来源: 题型:
| A、氟乙酸甲酯含有两种官能团 |
| B、1mol氟乙酸甲酯与NaOH水溶液共热最多消耗2mol NaOH |
| C、氟乙酸甲酯的同分异构体属于羧酸类的有2种 |
| D、氟乙酸甲酯加入稀硫酸共热后生成的有机物是HOCH2COOH和CH3OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨气分子是极性分子而甲烷是非极性分子 |
| B、NH3分子中有一对未成键的弧对电子,它对成键电子的排斥作用较强 |
| C、NH3为分子中N原子形成3个杂化轨道,CH4中C原子形成4个杂化轨道 |
| D、两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
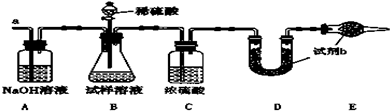
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com