

| A. | 烧瓶中的溶液呈红色,则原气体一定是SO2 | |
| B. | 烧瓶中的溶液呈蓝色,则原气体可能是NH3 | |
| C. | 形成喷泉的原因是烧瓶内压强大于外界大气压 | |
| D. | 若将石蕊改成氢氧化钠,则CO、CO2均能形成喷泉 |
分析 A.该气体必须极易溶于水,应该为HCl,不是二氧化硫;
B.石蕊试液变蓝色,说明气体的水溶液呈碱性;
C.烧瓶内产生喷泉的原因就是烧瓶内的气压小于大气压,烧杯内的水被压人烧瓶;
D.CO不与氢氧化钠溶液反应,无法形成喷泉.
解答 解:A.用石蕊溶液形成喷泉实验,且溶液呈红色,该气体必须极易溶于水的酸性气体,应该为HCl,二氧化硫的溶解度较小,不可能为SO2,故A错误;
B.烧瓶中的溶液呈蓝色,说明该气体为碱性气体,应该为氨气,故B正确;
C.圆底烧瓶中的气体极易溶于水或与烧杯中试剂反应,使瓶内压强减小,在大气压的作用下,烧杯中的液体会顺利进入烧瓶,形成喷泉,所以烧瓶内的气压小于大气压,故C错误;
D.若将石蕊改成氢氧化钠,CO2能形成喷泉,而CO不与氢氧化钠溶液反应,则CO无法形成喷泉,故D错误;
故选B.
点评 本题考查了喷泉实验,明确喷泉实验原理是解本题关键,注意不仅氯化氢、氨气和水能形成喷泉实验,氯气、二氧化硫等气体与碱液也能形成喷泉实验,只要这种气体极易溶于该溶液就能形成喷泉,为易错点,试题培养了学生的分析能力及化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ |
| N2O5 | 41 | 32 (升华) |
| N2O4 | -11 | 24 |
 ,相对分子质量137).步骤如下:在三口烧瓶中放入催化剂和30mL N2O5的CH2Cl2溶液(N2O5的浓度为lmol•L-1),30℃时,滴加15mL甲苯,充分反应得对硝基甲苯 1.73g.回答下列问题:
,相对分子质量137).步骤如下:在三口烧瓶中放入催化剂和30mL N2O5的CH2Cl2溶液(N2O5的浓度为lmol•L-1),30℃时,滴加15mL甲苯,充分反应得对硝基甲苯 1.73g.回答下列问题: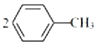 +N2O5$→_{△}^{催化剂}$
+N2O5$→_{△}^{催化剂}$ +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 浓度均为0.1mol•L-1、体积均为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg$\frac{v}{{v}_{0}}$的变化关系如图所示.下列叙述正确的是( )
浓度均为0.1mol•L-1、体积均为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg$\frac{v}{{v}_{0}}$的变化关系如图所示.下列叙述正确的是( )| A. | 常温下,由水电离出的c(H+)•c(OH -):a<b | |
| B. | HX、HY都是弱酸,且HX的酸性比HY的弱 | |
| C. | 相同温度下,电离常数K( HX):a>b | |
| D. | lg$\frac{v}{{v}_{0}}$=3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则$\frac{c({X}^{-})}{c({Y}^{-})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向10mL0.1mol/L的某一元酸HR溶液中逐滴加入0.1mol/L氨水,所得溶液pH及导电能力变化如图.下列分析不正确的是( )
常温下,向10mL0.1mol/L的某一元酸HR溶液中逐滴加入0.1mol/L氨水,所得溶液pH及导电能力变化如图.下列分析不正确的是( )| A. | a~b点导电能力增强说明HR为弱酸 | |
| B. | a、b点所示溶液中水的电离程度不相同 | |
| C. | b恰好完全中和,pH=7说明NH4R没有水解 | |
| D. | c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数 | 1.8×10-5 | 4.9×10-10 | K1=9.1×10-8 K2=1.1×10-12 |
| A. | 等物质的量浓度的各溶液 pH 关系为:pH(Na2S)>pH(NaCN)>pH(NaHS)>pH(CH3COONa) | |
| B. | 用 0.1mol/L 的 NaOH 溶液滴定 pH 值相等的CH3COOH和 HCN 溶液,CH3COOH消耗的NaOH溶液体积 更大 | |
| C. | NaHS 和Na2S 的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)+c(H2S) | |
| D. | 某浓度的NaCN溶液的 pH=d,则其中由水电离出的c(OH-)=10-4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 | |
| B. | 24Cr原子的电子排布式是1s22s22p63s23p63d44s2 | |
| C. | 若某基态原子的外围电子排布为4d25s2,它是第五周期IVB族元素 | |
| D. | M层全充满而N层为4s1的原子和位于第四周期第ⅠA族的原子是同一种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com