
【题目】(1)已知常温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,则该溶液的pH= ,此酸的电离平衡常数K= ,由HA电离出的H+的浓度约为水电离出的H+的浓度的 倍。
(2)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶剂。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
①向该溶液中加入少量盐酸时,发生反应的离子方程式是 ,向其中加入少量KOH溶液时,发生反应的离子方程式是 。
②现将0.04mol﹒L-1HA溶液和0.02mol﹒L-1NaOH溶液等体积混合,得到缓冲溶液。
a、若HA为HCN,该溶液显碱性,则溶液中c(Na+) c(CN-)(填“<”、“=”或“>”)。
b、若HA为CH3COOH,该溶液显酸性,溶液中所有的离子按浓度由大到小排列的顺序是 。
【答案】(1)4 10-7 106
(2)①A-+H+=HA HA+OH-=H2O+A-;
②a>b;c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
【解析】
试题分析:(1)已知常温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,则电离出的氢离子浓度为0.1mol/L×0.1%=10-4mol/L,因此该溶液的pH=4,此酸的电离平衡常数K=![]() 。溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度,即为10-10mol/L,则由HA电离出的H+的浓度约为水电离出的H+的浓度的
。溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度,即为10-10mol/L,则由HA电离出的H+的浓度约为水电离出的H+的浓度的![]() 倍。
倍。
(2)①含有弱酸HA和其钠盐NaA的混合溶液,向其中加入少量酸或碱时,溶液的酸碱性变化不大,是由于加入酸时发生A-+H+=HA,加入碱时发生 HA+OH-=H2O+A-,溶液中氢离子或氢氧根离子浓度变化不大而起到缓冲作用;
②a、该溶液显碱性,则c(H+)<c(OH-),根据溶液电中性原则可知c(Na+)+c(H+)=C(CN-)+c(OH-),则c(Na+)>c(CN-);
b、若HA为CH3COOH,该溶液显酸性,说明c(H+)>c(OH-),根据溶液电中性原则可知c(CH3COO-)>c(Na+),因此溶液中离子浓度大小顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某盐A是由三种元素组成的化合物,某研究小组按如图流程探究其组成:

请回答:
(1)写出红棕色固体C的化学式________________。
(2)写出A受热分解反应的化学方程式________________。
(3)写出检验A中阳离子的实验方案________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各数值表示有关元素的原子序数,其表示的各原子之间能以离子键形成稳定化合物的是( )。
A.10和19 B.6和16
C.14和8 D.11和17
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为铜锌原电池的装置图,根据装置图填写空白.
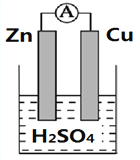
(1)将________转化为________的装置叫做原电池
(2)Zn极上的电极反应式为:_____________________________________。
(3)Cu极发生的是_____________反应(“氧化”或“还原”)。铜片上观察到的现象为___________________;
(4)溶液中H+的流动方向为__________________;
(5)若烧杯中溶液为AgNO3溶液,则负极为________(填Zn或Cu),总反应方程式为________________________________。
(6)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:A、B两个电极均由多孔的碳块组成。该电池的正极反应物为:___________。
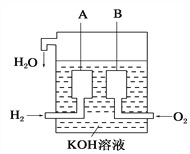
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定微粒的个数比为2∶1的是( )。
A.Be2+中的质子和电子
B.H原子中的中子和质子
C.NaHCO3中的阳离子和阴离子
D.BaO2(过氧化钡)固体中的阴离子和阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量的浓度和混合液的pH如下表所示:
实验编号 | HA的物质的量浓度(mol·L-1) | NaOH的物质的量浓度(mol·L-1) | 混合后溶液的pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.12 | 0.1 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还弱酸? 。
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是 。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)= mol/L。
Ⅱ.某二元酸(分子式用H2B表示)在水中的电离方程式是:H2B=H++HB-;HB-![]() H++B2-
H++B2-
回答下列问题:
(5)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 。
A.c(B2-)+c(HB-)=0.1mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NaCl等为原料制备KClO4的过程如下:
①在无隔膜、微酸性条件下,发生反应:NaCl+H2O—NaClO3+H2↑(未配平)
②在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3。
③一定条件下反应:4KClO3=3KClO4+KCl,将产物分离得到KClO4。
(1)电解时,产生质量为2.13g NaClO3,同时得到H2的体积为____________L(标准状况)。
(2)向NaClO3溶液中加入KCl能得到KClO3的原因是________________。

(3)该过程制得的KClO4样品中含少量KCl杂质,为测定产品纯度进行如下实验:
准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl- (反应为:3 KClO4+C6H12O6 ═ 6 H2O + 6 CO2↑+ 3 KCl),加入少量K2CrO4溶液作指示剂,用0. 20mol/L AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积21.00mL。滴定达到终点时,产生砖红色Ag2CrO4沉淀。
① 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,若c(CrO42-)=1.1×10-4mol/L,则此时c(Cl-)=________________mol/L。
② 计算KClO4样品的纯度(请写出计算过程。)______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 原电池的正极材料必须是金属
B. 原电池的负极发生还原反应
C. 实验室欲快速制取氢气,可利用粗锌与稀硫酸反应
D. 原电池可以把物质内部的能量全部转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.用化学用语回答下列问题:
(1)写出二氧化碳分子的电子式:_____________;
(2)写出氮气分子的结构式____________。
Ⅱ.下列物质:①N2 ②CO2 ③NH3 ④Na2O ⑤Na2O2 ⑥NaOH ⑦CaBr2 ⑧H2O2 ⑨NH4Cl ⑩HBr。
含有极性键和非极性键的是_______;
含有非极性键的离子化合物是_____。(填序号,下同)
Ⅲ.下列变化中:①干冰气化;②硝酸钾熔化;③KHSO4熔融;④硫酸溶于水;⑤蔗糖溶于水;⑥HI分解;⑦碘升华;⑧溴蒸气被木炭吸附。
(1)未破坏化学键的是_____________;
(2)仅离子键被破坏的是_____________;
(3)仅共价键被破坏的是_____________。
Ⅳ.下列物质:①1H、2H、3H ;②H2O、D2O、T2O;③O2、O3;④14N、14C
(1)互为同位素的是:______;
(2)互为同素异形体的是:______;
氢的三种原子1H、2H、3H 与氯的两种原子35Cl、37Cl相互结合为氯化氢,可得分子中相对分子质量不同的有________种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com