
分析 (1)跟金属铝反应生成H2的溶液可能为酸溶液,也可能为碱溶液,当生成Al3+时,溶液为酸溶液,当生成AlO2-时,溶液为碱溶液,然后利用离子的共存来分析.
(2)①该溶液中滴加酚酞试液数滴,溶液呈淡粉红色,因HCO3-水解生成OH-;
②充分加热①步所得的溶液,Mg2+、HCO3-反应生成氢氧化镁和二氧化碳,以此来解答;
(3)①NaHSO4溶液与NaHCO3溶液反应生成硫酸钠、水和二氧化碳;
①2mol/L的NaHSO4溶液与1mol/L的Ba(OH)2溶液等体积混合溶液中性,其反应式为:2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O,以此书写离子方程式;
至中性时溶液中溶质只有Na2SO4,加入Ba(OH)2溶液生成BaSO4沉淀.
解答 解:离子均为无色,所有离子均与无色透明溶液符合;铝既能与酸作用产生氢气,也能与碱作用产生氢气,
(1)溶液和铝粉反应后有AlO2-生成,溶液显碱性时,Mg2+、H+、Ag+、HCO3-不能存在,根据溶液不显电性,一定存在阳离子,即阳离子只有Na+,说明原溶液中的阴离子一定含OH-,可能含NO3-、Cl-;溶液和铝粉反应后有Al3+生成,溶液显酸性,则HCO3-、OH-不存在,由于硝酸与金属反应一般没有氢气产生,因此也不存在NO3-,根据溶液不显电性,一定存在阴离子,即溶液中肯定有Cl-,而Ag+可与Cl-生成沉淀,说明原溶液中也不存在Ag+,
故答案为:OH-、Na+;Cl-、NO3-;Ag+、OH-、HCO3-、NO3-;
(2)①该溶液中滴加酚酞试液数滴,溶液呈淡粉红色,因HCO3-水解生成OH-,水解离子反应为HCO3-+H2O?H2CO3+OH-,故答案为:HCO3-+H2O?H2CO3+OH-;
②加热①步所得的溶液,Mg2+、HCO3-反应生成氢氧化镁和二氧化碳,观察到有白色沉淀、产生气泡,碱性减弱,为中性溶液,则溶液为无色,离子反应为Mg2++2HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+2CO2↑,故答案为:白色沉淀、产生气泡;Mg2++2HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+2CO2↑;
(3)①NaHSO4溶液与NaHCO3溶液反应生成硫酸钠、水和二氧化碳,离子方程式:H++HCO3-═CO2↑+H2O,故答案为:H++HCO3-═CO2↑+H2O;
②NaHSO4是二元强酸的酸式盐,可以理解为全部电离.当反应后溶液呈中性时,其反应式为:2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O,则离子反应方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,此时溶液中溶质只有Na2SO4,加入Ba(OH)2的离子反应方程式为:Ba2++SO42-=BaSO4↓,
故答案为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;Ba2++SO42-=BaSO4↓.
点评 本题考查物质的检验及离子的共存问题,明确常见离子之间的反应、离子方程式的定量书写、溶液的酸碱性判断,为高频考点,把握水解原理及离子反应的书写方法为解答的关键,侧重水解反应的离子反应考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠固体与水反应:2O22-+2H2O═OH-+O2↑ | |
| B. | MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| C. | 稀硝酸与过量的铁屑反应Fe+4H-+NO3-═Fe3++NO↑+2H2O | |
| D. | NaAlO2溶液中通入过量二氧化碳AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铅蓄电池放电时,正极和负极的电极质量均增大 | |
| B. | 反应Cl2(g)+H2O(1)=HCl(aq)+HClO(aq)在常温下能自发进行,则该反应的△H<0 | |
| C. | 在N2(g)+3H2(g)?2NH3(g)平衡体系中加入催化剂,N2的反应速率和转化率均增大 | |
| D. | C2H5Br水解生成乙醇(△H>0),加入少量NaOH浓溶液并加热,该化学反应速率增大其平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烷烃分子中碳原子不可能在同一平面上 | |
| B. | 烷烃易被酸性高锰酸钾溶液氧化 | |
| C. | 在光照条件下,烷烃易与溴水发生取代反应 | |
| D. | 烷烃的卤代反应很难得到纯净的产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | ① | ② | ③ |
| 加入试剂(取等体积溶液) | 0.01mol/LKMnO4 0.1mol/LH2C2O4 | 0.01mol/LKMnO4 0.1mol/LH2C2O4 MnSO4固体 | 0.01mol/LKMnO4 0.1mol/LH2C2O4 Na2SO4固体 |
| 褪色时间/s | 116 | 6 | 117 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
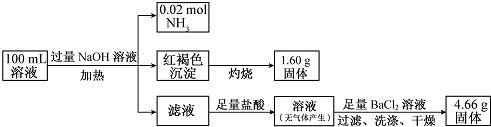
| A. | NH4+、Na+、SO42-一定存在,CO32--定不存在 | |
| B. | NH4+、SO42--定存在,CO32-、Na+-定不存在 | |
| C. | c(Cl-)至少为0.2 mol/L | |
| D. | c(Fe3+)一定为0.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| 总压强/1000kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
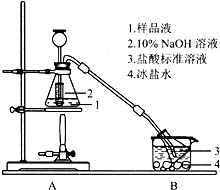 Cux(NH3)y(SO4)z•nH2O是深蓝色晶体,可溶于水,不溶于乙醇、乙醚等有机溶剂,常用作杀虫剂、媒染剂等.某小组利用废铜屑、硫酸、氨水等原料制备该晶体并测定其组成.
Cux(NH3)y(SO4)z•nH2O是深蓝色晶体,可溶于水,不溶于乙醇、乙醚等有机溶剂,常用作杀虫剂、媒染剂等.某小组利用废铜屑、硫酸、氨水等原料制备该晶体并测定其组成.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
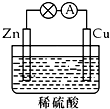
| A. | 铜极上发生氧化反应 | B. | 正极反应为:Cu-2e-=Cu2+ | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 反应一段时间后,溶液的酸性减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com