
分析 (1)发生水解的溶质应为含弱离子的盐;
(2)向10mL 0.1mol•L-1氨水中滴入酚酞溶液,显粉红色,是一水合氨电离出氢氧根离子的原因,加入少量NH4Cl晶体铵根离子浓度增大,电离平衡逆向进行溶液中氢氧根离子浓度减小;
(3)0.1mol•L-1的KAl(SO4)2溶液中铝离子水解溶液显酸性,向该溶液中滴入等体积等浓度的硫酸,抑制铝离子水解,溶液中水的电离程度减小.
解答 解:(1)发生水解的溶质应为含弱离子的盐,上述溶液中溶质能发生水解反应的是②0.1mol•L-1的NH4Cl溶液,④0.1mol•L-1的KAl(SO4)2溶液,
故答案为:②④;
(2)向10mL 0.1mol•L-1氨水中滴入酚酞溶液,显粉红色,再加入少量NH4Cl晶体,颜色变浅,氨水溶液中存在电离平衡,NH3•H2O?NH4++OH-,加入氯化铵晶体铵根离子浓度增大,电离平衡逆向进行氢氧根离子浓度减小,溶液红色变浅,
故答案为:浅;NH3•H2O?NH4++OH-,加入氯化铵晶体铵根离子浓度增大,电离平衡逆向进行氢氧根离子浓度减小,溶液红色变浅;
(3)0.1mol•L-1的KAl(SO4)2溶液中铝离子水解溶液显酸性,溶液中离子浓度大小为:c(SO42-)>c(K+)>c(Al3+)>c(H+)>c(OH-),向该溶液中滴入等体积等浓度的硫酸,抑制铝离子水解,抑制水的电离,溶液中水的电离程度小于纯水的电离程度,
故答案为:c(SO42-)>c(K+)>c(Al3+)>c(H+)>c(OH-);小于.
点评 本题考查了盐类水解、弱电解质电离平衡影响因素、电解质溶液中离子浓度大小、影响谁电离平衡因素分析判断等,掌握基础是解题关键,题目难度不大.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:解答题


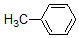 +H3C
+H3C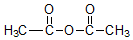 $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$ +CH3COOH
+CH3COOH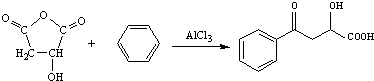 .
.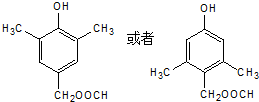 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
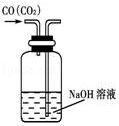 | 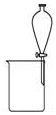 | 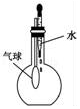 | 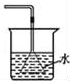 |
| A.除去CO气体中的CO2气体 | B.分离碘酒中的碘和酒精 | C.验证NH3的溶解性 | D.吸收HCl防倒吸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 塑料、合成纤维、合成橡胶主要是以石油、煤和天然气为原料生产的 | |
| B. | 利用丁达尔效应可以提纯混有葡萄糖的稀淀粉溶液 | |
| C. | 氨气、二氧化碳、乙醇都属于非电解质 | |
| D. | 硫氧化物和氮氧化物是形成酸雨的主要物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中一定存在SO42-和Cl- | |
| B. | 取③中滤液加入KSCN,溶液显红色,则原溶液一定有Fe3+ | |
| C. | 原溶液中一定不存在Ba2+和HCO3- | |
| D. | 为确定原溶液中是否含有K+,可通过焰色反应直接观察焰色是否为紫色来确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6和C5H12一定互为同系物 | |
| B. | 1mol葡萄糖与足量的金属钠反应,最多可生成2.5molH2 | |
| C. | 三氯甲烷只有一种结构证明甲烷是正四面体构型 | |
| D. | 油脂是食物中产生能量最高的营养物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+H2O═H2CO3 | B. | CO+CuO═Cu+CO2 | ||
| C. | 2H2O═2H2↑+O2↑ | D. | FeS+H2SO4═FeSO4+H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com