
分析 溶解度是在在某温度下,在100g的水中达到饱和时所溶解的溶质的质量.设30℃时AgNO3的溶解度为sg,根据AgNO3 饱和溶液的质量分数为75%,则有:$\frac{s}{100+s}×100%$=75%,求得s=300g.
(1)根据在30℃下,AgNO3的溶解度为300g可知,25gAgNO3 晶体投入15gH2O中能完全溶解,据此分析质量分数;
(2)a克AgNO3 晶体投入15克H2O中,如果AgNO3 晶体不能完全溶解,则得AgNO3 的饱和溶液;如果AgNO3 晶体能完全溶解,根据质量分数的求算公式来求算;
(3)25克AgNO3 晶体投入b克H2O中,如果AgNO3 晶体不能完全溶解,则得AgNO3 的饱和溶液;如果AgNO3 晶体能完全溶解,根据质量分数的求算公式来求算;
(4)a克AgNO3 晶体投入b克H2O中,如果AgNO3 晶体不能完全溶解,则得AgNO3 的饱和溶液;如果AgNO3 晶体能完全溶解,根据质量分数的求算公式来求算.
解答 解:溶解度是在在某温度下,在100g的水中达到饱和时所溶解的溶质的质量.设30℃时AgNO3的溶解度为sg,根据AgNO3 饱和溶液的质量分数为75%,则有:$\frac{s}{100+s}×100%$=75%,求得s=300g.即在30℃时,100g水中溶解300gAgNO3 晶体即达饱和.
(1)根据在30℃下,AgNO3的溶解度为300g可知,25gAgNO3 晶体投入15gH2O中能完全溶解,故所得溶液的质量分数ω=$\frac{25g}{25g+15g}$×100%=62.5%,答:溶液的质量分数为62.5%;
(2)a克AgNO3 晶体投入15克H2O中,如果AgNO3 晶体不能完全溶解,则得AgNO3 的饱和溶液,则溶液的质量分数为75%;如果AgNO3 晶体能完全溶解,则溶液的质量分数ω=$\frac{ag}{ag+15g}$×100%=$\frac{100a}{a+15}$%,答:溶液的质量分数为75%或$\frac{100a}{a+15}$%;
(3)25克AgNO3 晶体投入b克H2O中,如果AgNO3 晶体不能完全溶解,则得AgNO3 的饱和溶液,则溶液的质量分数为75%;如果AgNO3 晶体能完全溶解,则溶液的质量分数ω=$\frac{25g}{25g+bg}$×100%=$\frac{2500}{25+b}%$,答:溶液的质量分数为75%或$\frac{2500}{25+b}%$;
(4)a克AgNO3 晶体投入b克H2O中,如果AgNO3 晶体不能完全溶解,则得AgNO3 的饱和溶液,则溶液的质量分数为75%;如果AgNO3 晶体能完全溶解,则溶液的质量分数ω=$\frac{ag}{ag+bg}×100%$=$\frac{100a}{a+b}%$,答:溶液的质量分数为75%或$\frac{100a}{a+b}%$.
点评 本题考查了溶液质量分数的求算,应注意的是加入的硝酸银晶体能否完全溶解,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氟氯烃作制冷剂会加剧雾霾天气的形成 | |
| B. | 只通过电解的方法就能实现从食盐水到“84”消毒液的生产 | |
| C. | 加碘食盐中含有碘元素,能使淀粉溶液变蓝 | |
| D. | 工业上制漂白粉,所得的氯化物都具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
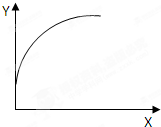 在一密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)=2C(g)+Q(Q>0),当达到平衡后,改变一个条件(X),下列量(Y)一定符合图中曲线的是( )
在一密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)=2C(g)+Q(Q>0),当达到平衡后,改变一个条件(X),下列量(Y)一定符合图中曲线的是( )| X | Y | |
| A | 温度 | 混合气体平均相对分子质量 |
| B | 再加入C | A的质量分数 |
| C | 再加入A | B的转化率 |
| D | 压强 | B的浓度 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-COOH | B. | CH2=CH-COOCH3 | C. | CH3CH2OH | D. | CH2=CH-CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用如图所示装置制取乙烯.
实验室用如图所示装置制取乙烯.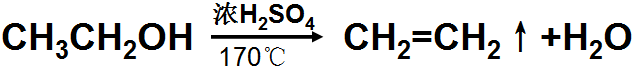
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
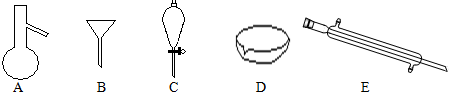
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com