
����Ŀ����ͼ��ʾ��ijͬѧ���һ��ȼ�ϵ�ز�̽���ȼҵԭ���ʹ�ͭ�ľ���ԭ���� ������װ���� X Ϊ�����ӽ���Ĥ��
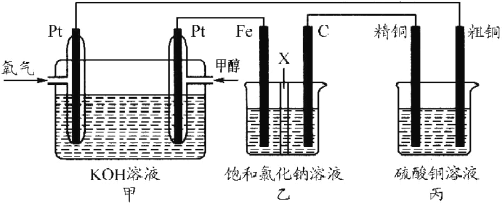
����Ҫ��ش�������⣺
(1)д�������ĵ缫��Ӧʽ_____
(2)д��ʯī�缫�ĵ缫��Ӧʽ_____________
(3)��Ӧһ��ʱ�����װ������������������Ҫ��_________(��������������ʯī����)����
(4)�����ͭ�к���п���������ʣ���װ���������ϵ缫��ӦʽΪ_________����Ӧһ��ʱ�䣬����ͭ��ҺŨ�Ƚ�_____(��������������С������������)��
(5)���ڱ�״���£��� 2.24 L �����μӷ�Ӧ������װ�������缫�����ɵ�����ķ�����ĿΪ_____����װ������������ͭ������Ϊ_____��
���𰸡�CH3OH-6e-+8OH-�TCO32-+6H2O 2Cl--2e-�TCl2�� ���� Cu-2e-=Cu2+��Zn-2e-=Zn2+ ��С 0.2��6.02��1023 12.8g
��������
(1)ȼ�ϵ���ǽ���ѧ��ת��Ϊ���ܵ�װ�ã�����ԭ��أ�Ͷ��ȼ�ϵĵ缫�Ǹ�����������ȼ��ʧ���ӷ���������Ӧ��Ͷ���������ĵ缫���������������������õ��ӷ�����ԭ��Ӧ��
(2)��ⱥ���Ȼ�����Һʱ������ԭ��ظ����ĵ缫������������ԭ��������ĵ缫�������������������ӷŵ磬�����������ӷŵ磬ע��������õ缫���������������ϵ缫���Ϸŵ��������Һ�������ӷŵ磻
(3)��ⱥ���Ȼ�����Һʱ�������������ӷŵ磬��������������Ũ�ȴ���������Ũ�ȶ�ʹ��Һ�ʼ��ԣ�
(4)��ͭ����ʱ����ͭ�������������Ͻ���ʧ���ӣ�������ͭ���ӵõ��ӣ������������Ͻ����ı仯ȷ����Һ��ͭ�����Ƿ�仯��
(5)���������ת�Ƶ�������ȣ�����ת�Ƶ�������ȼ�����װ�������缫�����ɵ�����ķ���������װ������������ͭ��������
(1)ȼ�ϵ���ǽ���ѧ��ת��Ϊ���ܵ�װ�ã�����ԭ��أ�Ͷ��ȼ�ϵĵ缫�Ǹ�����Ͷ���������ĵ缫�������������ϼ״�ʧ���Ӻ����������ӷ�Ӧ����̼������Ӻ�ˮ���缫��ӦʽΪ��CH3OH-6e-+8OH-�TCO32-+6H2O��
(2)�ҳ�����ӵ�Դ���ڵ��أ����缫����ԭ��صĸ�������������������ʯī�缫�������������������ӷŵ������������缫��ӦʽΪ��2Cl--2e-�TCl2����
(3)�ҳ�������������������̼�������������ӷŵ����������������������ӷŵ磬����������������������Ũ�ȴ���������Ũ����Һ�ʼ��ԣ�������װ������������������Ҫ����������
(4)�����ͭ�к���п���������ʣ������ϳ���ͭ������пʧ���ӽ�����Һ�������ĵ缫��ӦʽΪCu-2e-=Cu2+��Zn-2e-=Zn2+������������ͭ������ת�Ƶ��������֪���������ܽ��ͭС��������������ͭ�����Ա�װ���з�Ӧһ��ʱ�䣬����ͭ��ҺŨ�Ƚ���С��
(5)���ݴ��������ת�Ƶ�������ȵ�������������ͭ�Ĺ�ϵʽΪ��O2~~~~~2H2~~~~~2Cu�������������ķ�������x������ͭ��������y������װ�������缫�����ɵ������ķ�����ĿΪ![]() 2mol��6.02��1023mol-1=0.2��6.02��1023����װ������������ͭ������Ϊ
2mol��6.02��1023mol-1=0.2��6.02��1023����װ������������ͭ������Ϊ![]() ��2��64g/mol=12.8g��
��2��64g/mol=12.8g��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������ݡ�
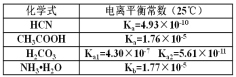
��1��25��ʱ��pH=11��NaCN��Һ��ˮ�������c(OH-)=_____molL-1��
��2��25��ʱ����Ũ�ȵ�NaCN��Na2CO3��Һ��CH3COONa������Һ��pHֵ�ɴ�С��˳��Ϊ_____��
��3��0.100molL-1NH4HCO3��Һ�����ʵ���Ũ������������_____���ѧʽ����
��4����NaCN��Һ��ͨ������CO2����������Ӧ�Ļ�ѧ����ʽΪ_____��
��5��25��1.10molL-1CH3COOH��Һ�У�CH3COOH�ĵ����ԼΪ_____��
��6��25��ʱ�������Ũ�ȵ�NaCl��NaCN����Һ�У���������NaCl_____NaCN(��������������С��������������)��
��7��HCN��NaOH��Ӧ�����Һ�д��ڣ�c(Na+)=c(CN-)������Һ��_____��(����������������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л����������������д����ȷ����
A.CH2Br��CH2Br ��������
B.CH3CH(NH2)CH2COOH 3-��������
C.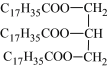 Ӳ֬�����֬
Ӳ֬�����֬
D. 2,2-����-3-����
2,2-����-3-����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ����Ĵ���֮һ�ڻ�ҩ����ըʱ������Ӧ�Ļ�ѧ����ʽΪ��S + 2KNO3 + 3C �� K2S + 3CO2��+ N2�������������������Ԫ�ػش��������⣺
(1)��ͼ��ʾΪԪ�����ڱ��м�Ԫ�ؿ�ͼ��������39.10����ʾ����________����Ԫ�������ڱ��е�λ��Ϊ___________________��

(2)����Ԫ���У������ӵ��Ӳ�ṹ���ԭ����ͬ�������Ӱ뾶����Ԫ�أ���ԭ�Ӻ�����_____�ֲ�ͬ�ܼ��ĵ��ӣ���֪����������һ�ֶ�Ӧˮ���������ȵ��ʷ�Ӧ���÷�Ӧ�Ļ�ѧ����ʽ��__________________________________��
(3)������Ӧ�������У����ڷǵ���ʵ���_________________��д�ṹʽ���������۵���ߵ����ʵĵ���ʽ��______________��
(4)������ѧ����ʽ��Ԫ���У�����ͬ����Ԫ�صķǽ�������ǿ������˳��Ϊ_______________����֤����ݱ���ɵ���ʵ��_______________������ĸ����
A������������Ӧˮ��������� B����̬�⻯��ķе�
C��������������Ӧ�����׳̶� D������������γɵĻ�������Ԫ�صĻ��ϼ�
(5)������Ӧ�У���1.5mol��ԭ��________�������õ�������ʧȥ����________ mol���ӣ�������_________ g��ԭ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯīΪ�缫�ֱ���ˮ�ͱ���ʳ��ˮ�������������ط�Ӧ��˵����ȷ���ǣ�������
A.������Ӧʽ��ͬ
B.������������Һ���pH��ͬ
C.������Ӧʽ��ͬ
D.ͨ����ͬ����ʱ���ɵ������������ȣ�ͬ��ͬѹ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҷ����׳Ʋ��ᣨ�ṹ��ʽΪHOOC��COOH���ɼ�дΪH2C2O4��������һ����Ҫ�Ļ���ԭ�ϣ���������0.01mol/L��H2C2O4��KHC2O4��K2C2O4��Һ��pH�����ʾ����
H2C2O4 | KHC2O4 | K2C2O4 | |
pH | 2.1 | 3.1 | 8.1 |
��գ�
��1��д��H2C2O4�ĵ��뷽��ʽ_______��
��2��KHC2O4��Һ�����Ե�ԭ����_____����0.1mol/L�IJ��������Һ��μ�NaOH��Һ�����ԣ���ʱ��Һ�������Ũ�ȹ�ϵ��ȷ����______��
a��c��K+��=c��HC2O4����+c��H2C2O4��+c��C2O42����
b��c��Na+��=c��H2C2O4��+c��C2O42����
c��c��K+��+c��Na+��=c��HC2O4����+c��C2O42����
d��c��K+����c��Na+��
��3��H2C2O4�����Ը��������Һ��Ӧ�������������ݣ�CO2����������ɫ��ʧ��д����Ӧ�����ӷ���ʽ______����֪�÷�Ӧ��ʼʱ���ʽ����������ӿ죬���ܵ�ԭ����_______��
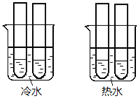
��4��ijͬѧ���ʵ����ͼ��ʾ�������ձ��е��Թܶ��ֱ�ʢ��2mL 0.1 mol/L H2C2O4��Һ��4mL 0.1mol/L ����KMnO4��Һ���ֱ��ϲ�����¼��Һ��ɫ����ʱ�䣮��ʵ��Ŀ�����о�________������ʵ��ʼ��û�п�����Һ��ɫ���Ʋ�ԭ��_______��
��5����֪���ᣨH2C2O4�����ȷֽ�Ļ�ѧ����ʽΪ��H2C2O4��H2O+CO��+CO2����д��FeC2O4���ܱ������и��·ֽ�Ļ�ѧ����ʽ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ϊ�����л��
�ټױ� ��1��3������ϩ ��ֱ������ ��ֲ����
��գ�
��1������ʹ��ˮ������ѧ�仯��ɫ��Ҳ��ʹ���Ը��������ɫ������____�����ţ���
��2���ܺ�����������Һ��Ӧ����______�����ţ���д���÷�Ӧ����֮һ�����������Ļ�ѧ����ʽ______��
��3����֪������ϩ����ͨ��1��3������ϩ����ϩ���������ӳɷ�Ӧ�õ���

ʵ��֤�������з�Ӧ�У���Ӧ����ӵĻ���˫���Ȼ���˫�������ױ�������

�ֽ���1��3������ϩΪ�л�ԭ�ϣ����Լ���ѡ��������;���ϳɼ������飺

��a��д���ṹ��ʽ��A______��B_____
��b������������������黥Ϊͬϵ�����_______
��c��1mol A��1mol HBr�ӳɿ��Եõ�_____�ֲ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в�������������ԭ�����͵���ʵ���� ��
A. ��ˮ��������ƽ�⣺Cl2+H2O![]() HCl+HClO�����պ���ˮ��ɫ��dz
HCl+HClO�����պ���ˮ��ɫ��dz
B. �ϳɰ���ҵʹ�ø�ѹ����߰��IJ���
C. ����H2(g)+I2(g)![]() 2HI(g)����ƽ�������С���������ʹ��ϵ��ɫ����
2HI(g)����ƽ�������С���������ʹ��ϵ��ɫ����
D. ��ˮ�����ϴ�ƿ�Ǻ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ����ͪ��һ����Ҫ���л�����ԭ�ϡ�ʵ���Һϳɻ���ͪ�ķ�Ӧ���£�
����ͪ��һ����Ҫ���л�����ԭ�ϡ�ʵ���Һϳɻ���ͪ�ķ�Ӧ���£�
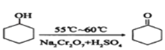
�������ͻ���ͪ�IJ����������ʼ��±���
���� | ��Է������� | �е�(��) | �ܶ�(g��cm��3��20��) | �ܽ��� |
������ | 100 | 161.1 | 0.9624 | ������ˮ���� |
����ͪ | 98 | 155.6 | 0.9478 | ����ˮ���������� |
����20 mL������������Na2Cr2O7������Ļ��Һ��ַ�Ӧ���Ƶ���Ҫ������ͪ��ˮ�Ĵֲ�Ʒ��Ȼ����з����ᴿ�������ᴿ�������漰����Ҫ����(δ����)��
a.����ȥ���Ѻ��ռ�151��156����֣�
b.ˮ��������(���ѷе�34.6 ������ȼ��)��ȡ����ȡҺ�����л��㣻
c.���ˣ�
d.��Һ���м���NaCl���������ͣ����ã���Һ��
e.������ˮMgSO4���壬��ȥ�л���������ˮ��
�ش��������⣺
(1)���������ᴿ�������ȷ˳����__________ (����ĸ)��
(2)b��ˮ����������ȡ��Ŀ����_______��
(3)���¹�����ȡ��Һ�����������У�����ȷ����__________��
A.ˮ��Һ�м������ѣ�ת������Һ©���У����ϲ���������ͼ������
B.���κ����Һ©���ϿڵIJ���������
C.���������������ֳַ�Һ©�����ô�Һ��ֲ�
D.��Һʱ�����Ƚ��Ͽڲ������������ϵİ��۶�©�����ϵ�С�ף��ٴ��������²�Һ��ȫ������ʱ���ٴ��Ͽڵ����ϲ�Һ��
(4)����������d�У�����NaCl�����������__________����������ѵIJ����в��õļ��ȷ�ʽΪ________��
(5)�������ʱ��һ��ʱ�����δͨ����ˮ��Ӧ��ȡ����ȷ������______��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com