
| A、所消耗的铜的质量相等 |
| B、所消耗的硝酸的量:②>①>③ |
| C、对环境造成的危害,③最小 |
| D、制取硝酸铜的最佳方案是③ |
| ||
| 8 |
| 3 |
| 2 |
| 3 |
| ||
| 8 |
| 3 |
| 2 |
| 3 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、Fe3+、Al3+ |
| B、Al3+ |
| C、Fe2+、 |
| D、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
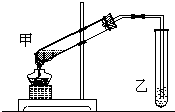 如图是某学生设计的制取乙酸乙酯的实验装置图,并采取了以下主要实验操作:
如图是某学生设计的制取乙酸乙酯的实验装置图,并采取了以下主要实验操作:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学研究性学习小组在实验室整理化学试剂时,发现一个盛有无色溶液的试剂瓶的标签污损,如右图所示.同学们根据中学化学知识,对该试剂的成分进行了一系列猜想和探究.
某化学研究性学习小组在实验室整理化学试剂时,发现一个盛有无色溶液的试剂瓶的标签污损,如右图所示.同学们根据中学化学知识,对该试剂的成分进行了一系列猜想和探究.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
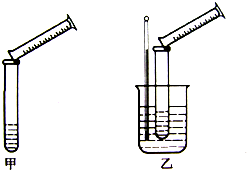 硫代硫酸钠与稀硫酸的反应为:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O.某实验兴趣小组用如下图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略)
硫代硫酸钠与稀硫酸的反应为:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O.某实验兴趣小组用如下图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略) | 实验组号 | 温度 | Na2S2O3 | H2SO4 | 加入H2O 的体积 | 出现沉淀 所需时间 | ||
| 体积 | 浓度 | 体积 | 浓度 | ||||
| Ⅰ | 0℃ | 5mL | 0.1mol/L | 10mL | 0.1mol/L | 5mL | 8s |
| Ⅱ | 0℃ | 5mL | 0.1mol/L | 5mL | 0.1mol/L | 10mL | 12s |
| Ⅲ | 30℃ | 5mL | 0.1mol/L | 5mL | 0.1mol/L | 10mL | 4s |
| Ⅳ | 30℃ | 5mL | 0.2mol/L | 5mL | 0.2mol/L | 10mL | 2s |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2s22p2 和2s22p4 |
| B、3s23p4 和2s22p4 |
| C、3s2 和2s22p5 |
| D、3s1 和3s23p4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com