
【题目】随原子序数的递增,八种短周期元素(用英文小写字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
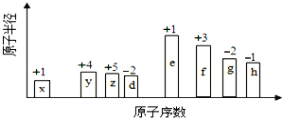
根据判断出的元素回答问题:
(1)f在元素周期表的位置是_________________。
(2)比较d、e简单离子的半径大小(用化学式表示,下同)_____________;比较g、h的最高价氧化物对应的水化物的酸性强弱是______________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式________________。
(4)已知1mol e的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:____________________________________________。
(5)由元素f、h形成的物质X与由元素x、z形成的化合物Y可发生以下反应:
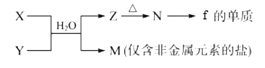
①写出X溶液与Y溶液反应的离子方程式____________________________________;
②写出工业上制备f的单质的化学方程式____________________________________。
【答案】第三周期第ⅢA族O2->Na+HClO4>H2SO4![]() (或
(或![]()
![]() ,答案合理即可)2Na(s)+O2(g)=Na2O2(s) △H=-511kJ·mol-1Al3++3NH3·H2O=Al(OH)3↓+3NH4+ (或Al3++3NH3+3H2O=Al(OH)3↓+3NH4+)2Al2O3(熔融)
,答案合理即可)2Na(s)+O2(g)=Na2O2(s) △H=-511kJ·mol-1Al3++3NH3·H2O=Al(OH)3↓+3NH4+ (或Al3++3NH3+3H2O=Al(OH)3↓+3NH4+)2Al2O3(熔融)![]() 4Al+3O2↑
4Al+3O2↑
【解析】
根据八种元素的最高正价或最低负价分析,x、y、z、d、e、f、g、h依次处于第IA族、第IVA族、第VA族、第VIA族、第IA族、第IIIA族、第VIA族、第VIIA族,结合原子序数和原子半径的图像,x、y、z、d、e、f、g、h依次为H、C、N、O、Na、Al、S、Cl元素。根据元素周期表、元素周期律和相关化学用语作答。
根据八种元素的最高正价或最低负价分析,x、y、z、d、e、f、g、h依次处于第IA族、第IVA族、第VA族、第VIA族、第IA族、第IIIA族、第VIA族、第VIIA族,结合原子序数和原子半径的图像,x、y、z、d、e、f、g、h依次为H、C、N、O、Na、Al、S、Cl元素。
(1)f为Al元素,Al在元素周期表的位置是第三周期第IIIA族。
(2)d、e的简单离子依次为O2-、Na+,O2-、Na+具有相同的电子层结构,核电荷数:O2-<Na+,离子半径:r(O2-)>r(Na+)。根据“同周期从左到右元素的非金属性逐渐增强,最高价氧化物对应水化物的酸性逐渐增强”,非金属性:S<Cl,最高价氧化物对应水化物的酸性:HClO4>H2SO4。
(3)上述元素组成的常见四原子共价化合物有:C2H2、NH3、H2O2等,它们的电子式依次为![]() 、
、![]() 、
、![]() 。
。
(4)Na(s)在O2(g)中燃烧生成Na2O2(s),反应的热化学方程式为Na(s)+![]() O2(g)=
O2(g)=![]() Na2O2(s)ΔH=-255.5kJ/mol(或2Na(s)+O2(g)=Na2O2(s)ΔH=-511kJ/mol)。
Na2O2(s)ΔH=-255.5kJ/mol(或2Na(s)+O2(g)=Na2O2(s)ΔH=-511kJ/mol)。
(5)由f、h组成的物质X为AlCl3,由x、z形成的化合物Y为NH3;X与Y在水溶液中反应生成M和Z,M是仅含非金属元素的盐,M为NH4Cl,Z为Al(OH)3,Al(OH)3受热分解生成的N为Al2O3,电解熔融Al2O3生成Al和O2。
①X溶液与Y溶液反应的化学方程式为:AlCl3+3NH3+3H2O=Al(OH)3↓+3NH4Cl(或AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl),反应的离子方程式为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+(或Al3++3NH3·H2O=Al(OH)3↓+3NH4+)。
②工业上电解熔融Al2O3制备Al,工业上制备Al的化学方程式为:2Al2O3(熔融)![]() 4Al+3O2↑。
4Al+3O2↑。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图,用2mL95%的乙醇,3mL无水醋酸,2mL浓H2SO4,制某有机溶剂的反应装置,试管b中加入5mL饱和碳酸钠溶液。连接好装置。用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验。

(1)在大试管a中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:_______________
(2)写出a试管中的主要化学反应的方程式:________________
(3)加入浓H2SO4的作用是_____________________。
(4)实验中球形干燥管除起冷凝作用外,另一个重要作用是___________________________。
(5)试管b中发生的反应_____________________________(离子方程式)
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)______。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
(7)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图,图中圆括号表示加入适当的试剂,编号表示适当的分离方法。

①写出各有机物的名称:
A __________________,B ____________________ ,E __________________ 。
②写出加入的试剂:(a)________________,(b)___________________。
③写出有关的操作分离方法:①______________③_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关分散系的叙述中不正确的是( )
A.胶体分散质微粒直径较大,不能透过滤纸
B.液态分散系根据分散质粒子大小分为溶液、胶体和浊液三类
C.利用丁达尔效应可以区分溶液和胶体
D.纳米材料分散到液体分散剂中得到的分散系属于胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为________________、____________________________,制得等量H2所需能量较少的是_____________。
(2)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中。2 min后,反应达到平衡,水的物质的量为0.01mol。
COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中。2 min后,反应达到平衡,水的物质的量为0.01mol。
① H2S的平衡转化率α=_______%
②从反应开始到平衡,CO2的平均反应速率为_________________
(3)在一定条件下,用H2O2氧化H2S。随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同。在酸性溶液中,当n(H2O2)/n(H2S)=4时,写出离子方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或现象不能用勒沙特列原理解释的是
|
|
A.卤化银沉淀的转化 | B.配制FeCl3溶液 |
|
|
C.酯水解程度比较 | D.探究石灰石与稀盐酸在密闭环境下的反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】福韦酯(TDF)主要用于治疗艾滋病毒(HIV)感染,化合物W是合成TDF的重要中间体,其合成路线如图所示。
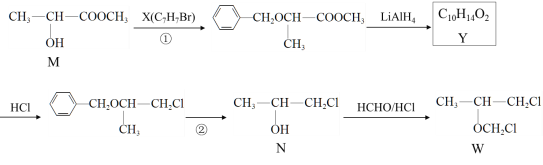
完成下列填空:
(1)N所含官能团的名称是______________;Y的结构简式是____________________。
(2)X可用苯的一种同系物制备,所需的无机试剂与条件是____________________。
(3)写出检验W中是否有残留甲醛的化学方程式____________________________________。
(4)①②的目的是_______________________。
(5)写出M符合下列条件的一种同分异构体的结构简式。_______________
i. 与M具有相同官能团 ii. 能发生银镜反应
(6)写出用M为原料制备聚丙烯酸( )的合成路线_______________________ 。
)的合成路线_______________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲用下列装置制备氯水并探究其性质。
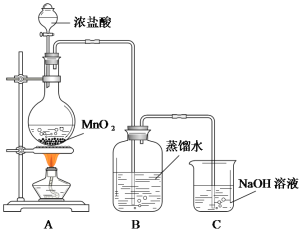
已知:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)C装置的作用是__________________________________。
(2)氯水制备完成后,甲同学从B中取出一定量的样品置于日光下照射一段时间,发现样品某些性质发生了明显的变化,请各列举一项:
物理性质变化:______________________________________________________;
化学性质变化:_______________________________________________________。
(3)乙同学从B中取出一定量的样品后通入SO2,充分作用后再滴入少量品红溶液,发现品红溶液不褪色。原因是__________________________________(用离子方程式表示)。丙同学改变通入SO2的量,重复乙同学的操作,发现品红溶液红色褪去。他提出:假设①:SO2过量,多余的SO2使品红溶液褪色;假设②:_________________________。请设计实验验证假设①是否成立:______________________。
(4)为证明氯气与水反应产物具有漂白性,丁同学将A中产生的气体缓缓通过下列装置:

试剂a应选择_______________;试剂b应选择_______________。
(5)戊同学从B中取出少量样品,滴到NaHCO3粉末上,有无色气泡产生,由此他认为氯气与水反应至少产生一种酸性强于碳酸的物质。请评价他的观点是否正确并说明理由________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、H、O三种元素在人体内质量分数约为73%左右,而在组成岩石圈的化学成分中还不到1%,这一事实说明了( )
A. 生物界与非生物界具有相似性
B. 生物界与非生物界的元素组成是不同的
C. 生物界与非生物界具有统一性
D. 生物界与非生物界存在差异性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com