
【题目】实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图(铁架台、铁夹、酒精灯等未画出):

取17.1 g A放入装置中,通入过量O2燃烧,生成CO2和H2O,请回答下列有关问题:
(1)通入过量O2的目的是______________________________________________。
(2)C装置的作用是__________________________________________;
D装置的作用是_____________________________________________。
(3)通过该实验,能否确定A中是否含有氧原子?________。
(4)若A的摩尔质量为342 g/mol,C装置增重9.99 g,D装置增重26.4 g,则A分子式为____________。
(5)写出A燃烧的化学方程式_____________________________________。
(6)A可发生水解反应,1 mol A可水解生成2 mol同分异构体,则A在催化剂作用下水解的化学方程式为_________________________________________。
【答案】使有机物A充分燃烧 吸收A燃烧后生成的H2O 吸收A燃烧后生成的CO2 能 C12H22O11 C12H22O11+12O2![]() 12CO2+11H2O C12H22O11(蔗糖)+H2O
12CO2+11H2O C12H22O11(蔗糖)+H2O![]() C6H12O6(葡萄糖)+C6H12O6(果糖)
C6H12O6(葡萄糖)+C6H12O6(果糖)
【解析】
(1)通入过量O2可以使有机物A充分燃烧,防止生成CO。
(2)浓硫酸具有吸水性,所以C装置的作用是吸收A燃烧后生成的H2O;碱石灰可以吸收CO2,所以D装置的主要作用是吸收A燃烧后生成的CO2。
(3)根据原子守恒可知和质量守恒定律可以判断出有机物中是否含有氧原子。
(4)根据题意A的物质的量是17.1g÷342 g/mol=0.05mol。水蒸气的物质的量是9.99g÷18g/mol=0.55mol,CO2的物质的量是26.4g÷44gmol=0.6mol。所以有机物中含有的碳、氢原子数目分别是0.6÷0.05=12、0.55×2÷0.05=22。所以含有的氧原子数目是![]() ,即A的分子式是C12H22O11。
,即A的分子式是C12H22O11。
(5)A燃烧的生成物是水和CO2,所以燃烧的化学方程式是C12H22O11+12O2![]() 12CO2+11H2O。
12CO2+11H2O。
(6)1 mol A可水解生成2 mol同分异构体,则根据A的分子式可知,A是蔗糖,水解生成葡萄糖和果糖,化学方程式是C12H22O11(蔗糖)+H2O![]() C6H12O6(葡萄糖)+C6H12O6(果糖)。
C6H12O6(葡萄糖)+C6H12O6(果糖)。


科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
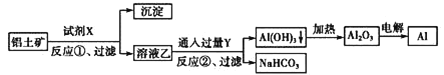
下列叙述不正确的是( )
A.试剂X可以是氢氧化钠溶液
B.反应①过滤后所得沉淀为氧化铁
C.图中所示转化反应都不是氧化还原反应
D.反应①的离子方程式为Al2O3+2OH-=2AlO2-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物分子式为C4H8,据此推测其结构和性质不可能的是
A. 它与乙烯可能是同系物
B. 一氯代物只有一种
C. 等质量的CH4和C4H8,分别在氧气中完全燃烧,CH4的耗氧量小于C4H8
D. 分子结构中甲基的数目可能是0、1、2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是周期表中短周期的一部分,A、B、C三种元素原子核外的电子数之和等于B原子的质量数。B原子核内的质子数和中子数相等。下列叙述不正确的是( )
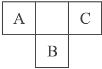
A. 三种元素的原子半径的大小顺序是B>C>A
B. A元素最高价氧化物对应的水化物具有强氧化性
C. B元素的氧化物、氢化物的水溶液都呈酸性
D. C元素是非金属性最强的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到相应实验目的的是
选项 | 实验目的 | 实验操作 |
A | 探究I-与Fe2+的还原性强弱 | 向FeCl3稀溶液中依次加入KI溶液、淀粉 |
B | 探究HPO42-在水溶液中的电离程度与水解程度的相对大小 | 测定0.1 mol·L-1NaH2PO4溶液的pH |
C | 配制0.1 mol·L-1邻苯二甲酸氢钾( | 称取5.1 g邻苯二甲酸氢钾于烧杯中,加入少量蒸馏水溶解,转移至500 mL容量瓶中定容 |
D | 比较CaCO3和CaSO4的Ksp大小 | 向澄清石灰水中滴入0.1 mol·L-1Na2CO3溶液至不再有沉淀产生,再滴加0.1 mol·L-1Na2SO4溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiSO4是化学镀镍的原料,一种用废雷尼镍催化剂(已预处理,主要含NiO,还含有少量Fe、Cr及不溶物)制备NiSO4·7H2O的工艺流程如下:

回答下列问题:
(1)化学镀镍总反应为6NaOH+2NiSO4+NaH2PO2=2Ni+Na3PO4+2Na2SO4+4H2O,每生成1 mol Ni,转移电子的物质的量为____。
(2)“溶解”时,在反应器中加入湿料及水,为节约能耗,且维持反应始终在一定温度下进行,应进行的操作是________。
(3)“氧化”时,Fe2+被氧化的离子方程式为________。
(4)“滤渣2”的成分是______。
已知在实验条件下,几种离子开始沉淀和沉淀完全的pH如下表所示:
Ni2+ | Fe2+ | Cr3+ | Fe3+ | |
开始沉淀pH | 6.2 | 7.6 | 4.5 | 2.3 |
沉淀完全pH | 8.6 | 9.1 | 5.6 | 3.3 |
(5)“浓缩”时,加入H2SO4调节pH为3.5~4.0的目的是____;由浓缩液得到产品的步骤为____。
(6)测定产品镍的质量分数[w(Ni)]的实验步骤如下:准确称取0.1000 g产品于250 mL锥形瓶内,加入25 mL水、0.5 g氟化钠、10 mL氨性缓冲溶液、约0.1 g紫脲酸铵指示剂,摇匀,用0.0250 mol·L-1 EDTA滴定至试液呈紫红色为终点(Ni2++H2Y2-=NiY2-+2H+),消耗EDTA溶液14.00 mL,则产品中w(Ni)=____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g),若将1 mol氮气和3 mol氢气充入密闭容器中,反应达平衡时,氨气的体积分数为a。保持相同条件,在密闭容器中分别充入下列物质, 反应达平衡时,氨气的体积分数不可能为a的是
2NH3(g),若将1 mol氮气和3 mol氢气充入密闭容器中,反应达平衡时,氨气的体积分数为a。保持相同条件,在密闭容器中分别充入下列物质, 反应达平衡时,氨气的体积分数不可能为a的是
A. 2 mol NH3B. 1 mol N2、3 mol H2和2 mol NH3
C. 0.5 mol N2、1.5 mol H2和1 mol NH3D. 0.1 mol N2、0.3 mol H2和1.8 mol NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两烧瓶中各盛有100mL 3mol·L-1的盐酸和氢氧化钾溶液;向两烧瓶中分别加入等质量的铝粉,反应结束测得生成的气体体积甲∶乙=2∶3(相同状况),则加入铝粉的质量为( )
A. 2.7g B. 3.6g C. 5.04g D. 4.05g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com