
| 电离出的各个离子平衡浓度系数次方的乘积 |
| 弱酸的平衡浓度 |
| c(HCO3-)?C(H+) |
| c(H2CO3) |
| c(HCO3-)?C(H+) |
| c(H2CO3) |
| 0.1mol/L |
| 2 |


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
 铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境.改进实验的设计符合绿色化学的思想.某兴趣小组设计出下图所示装置置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化.
铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境.改进实验的设计符合绿色化学的思想.某兴趣小组设计出下图所示装置置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化.| 方案 | 反应物 |
| 甲 | Cu、浓硝酸 |
| 乙 | Cu、稀硝酸 |
| 丙 | Cu、O2、稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)pH=13的CH3COONa溶液加水稀释100倍后,pH
(1)pH=13的CH3COONa溶液加水稀释100倍后,pH查看答案和解析>>
科目:高中化学 来源: 题型:
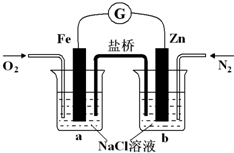
| A、烧杯a中的溶液pH降低 |
| B、锌是化学电源的正极 |
| C、烧杯a中发生的反应为2H++2e-=H2↑ |
| D、盐桥中的阳离子向铁电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、x+y>z |
| B、A的体积分数下降 |
| C、B的转化率降低 |
| D、C的体积分数下降 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com