

 0.5NA > CO32-+H2O
0.5NA > CO32-+H2O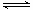 HCO3-+OH- HCO3-+H2O
HCO3-+OH- HCO3-+H2O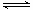 H2CO3+OH-
H2CO3+OH-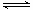 H2SO3 紫色石蕊试液变红
H2SO3 紫色石蕊试液变红

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.干冰和氨都属于弱电解质 |
| B.NO2和SO2都是形成酸雨的气体 |
| C.淀粉、纤维素和油脂都属于天然高分子化合物 |
| D.常温下,铁、铝遇到稀硝酸表面会生成一层致密的氧化膜,发生钝化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.将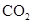 通入 通入 溶液中至饱和,无沉淀产生;再通入 溶液中至饱和,无沉淀产生;再通入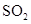 ,产生沉淀 ,产生沉淀 |
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入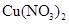 固体,铜粉仍不溶解 固体,铜粉仍不溶解 |
C.向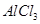 溶液中滴加氨水,产生白色沉淀;再加入过量 溶液中滴加氨水,产生白色沉淀;再加入过量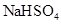 溶液,沉淀消失 溶液,沉淀消失 |
D.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量 固体,速率不改变 固体,速率不改变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③ | B.④⑤ | C.①② | D.②③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②⑤ | B.①③⑤ | C.②④⑥ | D.①②③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
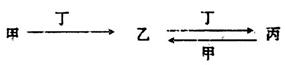
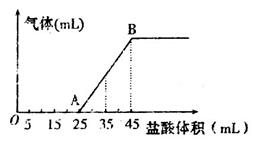
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cl2、SO2均能使品红溶液褪色,说明两者均有氧化性 |
| B.SiO2、Al2O3均可和酸与碱反应,说明两者均为两性氧化物 |
| C.浓硫酸、浓硝酸在常温下均能使铁铝钝化,说明两者均有强氧化性 |
| D.钠、铁的金属性均比铜的强,说明两者均可以从硫酸铜溶液中置换出单质铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com