
【题目】某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如下图所示,下列说法不合理的是
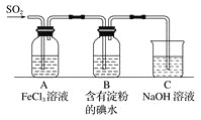
A. 能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B. 装置C的作用是吸收SO2尾气,防止污染空气
C. 为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去
D. 为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
【答案】C
【解析】
A、B中蓝色褪去,说明二氧化硫和碘单质反应,I2+SO2+2H2O=2HI+H2SO4,依据氧化还原反应中还原剂的还原性大于还原产物,二氧化硫还原性大于碘离子,故A正确;
B、二氧化硫是污染性气体不能排放到空气中,需要用氢氧化钠溶液吸收,因此装置C的作用是吸收SO2尾气,防止污染空气,故B正确;
C、二氧化硫、亚铁离子都具有还原性,都可以和高锰酸钾溶液发生反应使之褪色,不能验证A中发生了氧化还原反应,故C错误;
D、铁离子氧化二氧化硫为硫酸,2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,加入氯化钡生成白色沉淀说明反应进行生成了硫酸根离子,故D正确;
故答案选C。


科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)向偏铝酸钠溶液中滴入1~2滴酚酞溶液,溶液显____色,用离子方程式表示原因________。
(2)Fe(OH)3胶体可用作净水剂,取少量Fe(OH)3胶体于试管中,向试管中逐渐滴加稀盐酸至过量,现象为_________________________
(3)已知:5NH4NO3![]() 2HNO3+4N2↑+9H2O,则该反应中氧化产物与还原产物的质量比为______。
2HNO3+4N2↑+9H2O,则该反应中氧化产物与还原产物的质量比为______。
(4)有机物CH3CH(C2H5)CH(C2H5)CH(CH3)2系统命名法命名为 ______________________
(5)邻甲基苯甲酸( )有多种同分异构体,其中属于酯类,但分子结构中含有甲基和苯环的异构体有____________种
)有多种同分异构体,其中属于酯类,但分子结构中含有甲基和苯环的异构体有____________种
(6)甲酸和甲醇发生酯化反应方程式______________________________________________
(7)![]() 与足量NaOH溶液反应的化学方程式______________;
与足量NaOH溶液反应的化学方程式______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅、铜、镓、硒等化学物质可作为制造太阳能电池板的材料。
(1)镓是ⅢA族元素,写出基态镓原子的核外电子排布式__________________。
(2)硒为第四周期ⅥA族元素,与其相邻的元素有砷(33号)、溴(35号),则三种元素的电负性由大到小的顺序为______________(用元素符号表示)。
(3)SeO3分子的立体构型为____,与硒同主族元素的氢化物(化学式为H2R)中,沸点最低的物质化学式为____。
(4)硅烷(SinH2n+2)的沸点与其相对分子质量的关系如图所示,呈现这种变化的原因是____________。

(5)金属铜投入氨水中或投入过氧化氢溶液中均无明显现象,但投入氨水与过氧化氢的混合液中,则铜片溶解,溶液呈深蓝色,写出使溶液呈深蓝色的离子的化学式_____。
(6)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数之比为____________,若该晶体的晶胞边长为a pm,则该合金的密度为________________g·cm-3(列出计算式,不要求计算结果,设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列括号中的物质为杂质,请写出除杂的离子方程式。
(1)![]() ;离子方程式为____________________________________。
;离子方程式为____________________________________。
(2)![]() :离子方程式为____________________________________。
:离子方程式为____________________________________。
(3)![]() :离子方程式为____________________________________。
:离子方程式为____________________________________。
(4)![]() :离子方程式为____________________________________。
:离子方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一块金属钠投入到滴有紫色石蕊试液的盛冷水的烧杯中,甲同学认为可观察到下列现象,其中正确的有( )
①钠投入水中,先沉入水底,后浮出水面
②钠立即与水反应,并有气体产生
③反应后溶液变红
④钠熔成闪亮的小球
⑤小球在水面上四处游动
⑥有“嘶嘶”的响声发出
A. ①②③④ B. ②③④⑤
C. ②④⑤⑥ D. ③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化铟和砷化铟纳米晶具备独特的光学和电学特性,广泛应用于生物医学、通信、太阳能电池等领域。回答下列问题:
(1)基态磷原子电子排布式为____________;基态As原子中未成对电子数为__________。
(2)PH3分子空间构型为_______;AsO33-中As原子的杂化方式为____________。
(3)AsH3与NH3在水中溶解度较大的是________,其原因是_________________。
(4)酞菁铟是有机分子酞菁与金属铟形成的复杂分子,结构简式如下图I所示,该分子中存在的化学键为___(填选项字母)。

(5)砷化铟的晶胞绐构如上图II所示,砷化铟晶体的化学式为_______________;该晶胞的棱长为acm,则砷化铟晶体的密度为__________(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,亚砷酸(H3AsO3)水溶液中含砷的各物种的分布分数(平衡时某物种的物质的量浓度占各物种的物质的量浓度之和的分数)与pH的关系如图所示。下列说祛正确的是

A. 以酚酞为指示剂,用NaOH溶液滴定到终点时发生的主要反应为H3AsO3+2OH-==HasO32-+H2O
B. pH=11时,溶液中有c(H2AsO3-)+2c(HAsO32-)+c(OH-)=c(H+)
C. 若将亚砷酸溶液加水稀释,则稀释过程中c(HAsO32-)/ c(H2AsO3-)减小
D. Ka1(H3AsO3)的数量级为10-10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中不正确的个数是
①铝在空气中很容易燃烧
②明矾在水中能生成Al(OH)3胶体,可用作净水剂
③含硅4%的钢具有良好的导磁性,可用来制造变压器铁芯
④滴有酚酞溶液的水中加Na2O2,溶液变红
⑤取等量的两瓶失去标签的Na2CO3和NaHCO3无色饱和溶液于两支试管中,滴加Ba(OH)2溶液, 生成白色沉淀的是Na2CO3溶液
⑥铁红是磁性氧化铁,常用作红色油漆和涂料
⑦铁与水蒸气在高温下的反应产物为Fe2O3和H2
A. 2个 B. 3个 C. 4个 D. 5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)高铁酸钾![]() 是一种新型、高效、多功能水处理剂。某学习小组设计如下方案制备高铁酸钾:
是一种新型、高效、多功能水处理剂。某学习小组设计如下方案制备高铁酸钾:
![]()
①高铁酸钾中铁元素的化合价为________,据此推测它具有的化学性质是____________。
②其中第一步操作是:在NaClO溶液中加入烧碱固体形成强碱性环境,将研磨过的硝酸铁少量多次地加入上述溶液中,冰水浴中反应1 h。发生的离子反应为2Fe3++3ClO-+10OH-===2FeO![]() +3Cl-+5H2O,还原剂是_____________。
+3Cl-+5H2O,还原剂是_____________。
③高铁酸钾和水发生反应,生成物能吸附杂质净水,同时还产生气体,写出反应的离子方程式:___________________。
(2)某Fe 2(SO4) 3样品含有少量FeSO4杂质,为了测定该样品中铁元素的含量,设计如下实验:
Ⅰ.称取样品m g,加入稀H2SO4,后加水配制成250.00 mL溶液;
Ⅱ.取25.00 mL溶液,先加入![]() ,然后再加过量的氨水,过滤;
,然后再加过量的氨水,过滤;
Ⅲ.将沉淀用蒸馏水洗涤数次后,烘干;
Ⅳ.灼烧至质量不再减少为止,得到红棕色固体,冷却后称量,质量为n g。
请根据上面操作流程,回答以下问题:
①步骤Ⅰ中称量使用的仪器是________________,配制用到的仪器有烧杯、玻璃棒、胶头滴管,还要补充的玻璃仪器是____________________。
②步骤Ⅱ中过滤用的仪器有滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是_________;加入![]() 的主要目的是________________。
的主要目的是________________。
③步骤Ⅲ中检验该沉淀已经洗涤干净的操作是________________。
④若要检验溶液中的![]() ,则应该加入________________试剂。
,则应该加入________________试剂。
⑤计算该样品中铁元素的质量分数的表达式是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com