
(1)若所得混合液为中性,则a∶b=____________;此溶液中各种离子的浓度由大到小的排列顺序是____________。
(2)若所得混合液的pH=2,则a∶b=____________。此溶液中各种离子的浓度由大到小的排列顺序是____________。
解析:因为KW=1×10-13>1×10-14,所以水的温度应大于25 ℃。该NaOH溶液中c(OH-)=10-13/c(H+)=![]() mol·L-1=10-2 mol·L-1,n(OH-)=a L×10-2 mol·L-1=10-2a mol。该稀硫酸中n(H+)=b L×10-1 mol·L-1=10-1 b mol。
mol·L-1=10-2 mol·L-1,n(OH-)=a L×10-2 mol·L-1=10-2a mol。该稀硫酸中n(H+)=b L×10-1 mol·L-1=10-1 b mol。
(1)混合后溶液呈中性,n(H+)=n(OH-),即10-1b=10-2a。a∶b=10∶1。反应后为Na2SO4溶液,由此确定离子浓度大小顺序。
(2)由题意可知:10-1 mol-10-2a mol=10-2 mol·L-1×(a+b) L,解得a∶b=9∶2。反应后溶液中离子的物质的量之比n(H+)∶n(![]() )∶n(Na+)=10-2(9+2)∶10-1×2/2∶10-2×9=11∶10∶9,得离子浓度大小顺序。
)∶n(Na+)=10-2(9+2)∶10-1×2/2∶10-2×9=11∶10∶9,得离子浓度大小顺序。
答案:大于 室温时水的KW=1×10-14(小于1×10-13),水的电离是吸热的,升温时水的电离平衡正向移动,KW增大
(1)10∶1 c(Na+)>c(![]() )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
(2)9∶2 c(H+)>c(![]() )>c(Na+)>c(OH-)
)>c(Na+)>c(OH-)


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
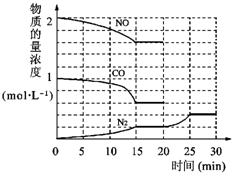 环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素.
环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素. O2+Hb?CO
O2+Hb?CO N2(g)+2CO2(g)△H=-113kJ?mol-1
N2(g)+2CO2(g)△H=-113kJ?mol-1| 0.4 |
| 15 |
| 0.4 |
| 15 |
 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A | B | C | D | |
| n(CO2) | 3 | 1 | 0 | 1 |
| n(H2) | 2 | 1 | 0 | 1 |
| n(CO) | 1 | 2 | 3 | 0.5 |
| n(H2O) | 5 | 2 | 3 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省魏县一中高二上学期期中考试化学试卷 题型:填空题
(8分)某温度(t°C)时,测得0.0 1mol·L-1的NaOH溶液的pH为11,则该温度下水的Kw= .(2分)
1mol·L-1的NaOH溶液的pH为11,则该温度下水的Kw= .(2分)
在此温度下,将pH=a的H2SO4溶液VaL与pH=b的NaOH溶液VbL混合.
(1)若所得混合液为中性,且a=2,b=12,则Va∶Vb= ;(3分)
(2)若所得混合液的pH=10,且a=2,b=12,则Va∶Vb= 。(3分)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com