
 随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.
随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示. .
.分析 从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素,
(1)f是Al元素,原子核外有3个电子层,最外层电子数为3,在元素周期表的位置是第三周期ⅢA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,非金属性越强,最高价氧化物水化物的酸性越强;
(3)x与z形成四原子共价化合物为NH3;
(4)已知1mol钠的单质在足量氧气中燃烧,生成过氧化钠固体,恢复至室温,放出255.5kJ热量,由此分析解答.
解答 解:从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
(1)f是Al元素,原子核外有3个电子层,最外层电子数为3,在元素周期表的位置是第三周期ⅢA族,
故答案为:第三周期ⅢA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:r(O2-)>r(Na+);非金属性越强,最高价氧化物水化物的酸性越强,故酸性:HClO4>H2SO4,
故答案为:r(O2-)>r(Na+);HClO4>H2SO4;
(3)x与z形成四原子共价化合物为NH3,电子式为 ,
,
故答案为: ;
;
(4)已知1mol钠的单质在足量氧气中燃烧,生成过氧化钠固体,恢复至室温,放出255.5kJ热量,所以反应的热化学方程式为:2Na(s)+O2(g)=Na2O2(s)△H=-511kJ•mol-1,故答案为:2Na(s)+O2(g)=Na2O2(s)△H=-511kJ•mol-1.
点评 本题考查结构位置性质关系、离子半径的大小比较、元素周期律、电子式、热化学方程式的书写等,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳能使漂白粉水溶液先变浑浊后变澄清,二氧化硫也有同样现象 | |
| B. | 加热条件下,钠与氧气反应生成过氧化钠,锂与氧气反应也生成过氧化锂 | |
| C. | 常温下,浓硝酸能使铁、铝钝化,浓硫酸也能使铁、铝钝化 | |
| D. | 铁可置换出硫酸铜溶液中的铜,钠也可置换出硫酸铜溶液中的铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
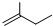 ③
③
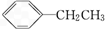 ⑤CH≡CCH3 ⑥CH3(CH2)4CH3.
⑤CH≡CCH3 ⑥CH3(CH2)4CH3.| A. | ①②③④ | B. | ③④⑤ | C. | ①②④⑥ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中SO2不能全部转化为SO3 | |
| B. | 无限增加反应时间,SO2能全部转化为SO3 | |
| C. | 达到化学平衡时,反应混合物中同时存在SO2、O2、SO3 | |
| D. | 达到化学平衡时,SO3的生成速率等于SO3的分解速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com