
| m |
| M |
| ||
| 2.2g |
| 44g/mol |
| ||


科目:高中化学 来源: 题型:
 铊的相关信息卡片如图所示:
铊的相关信息卡片如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
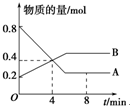 某温度时,在2L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:
某温度时,在2L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:查看答案和解析>>
科目:高中化学 来源: 题型:

| A、1mol绿原酸与足量NaOH溶液反应,最多消耗4mol NaOH |
| B、1mol绿原酸与足量溴水反应,最多消耗2.5mol Br2 |
| C、分子中所有的碳原子均可能在同一平面内 |
| D、绿原酸水解产物均可以与FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若溶液中c(NH4+)=c(Cl-),则该溶液一定显中性 |
| B、若溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶液中一定含有NH4Cl和NH3?H2O |
| C、若溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶液中可能含有NH4Cl或可能含有NH4Cl和HCl |
| D、若溶液中c(Cl-)>c(H+)>c(NH4+)>c(OH-),则溶液中含有大量的NH4Cl和少量的HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属Na、Mg、Al的硬度依次降低 |
| B、O、F、H的原子半径依次减小 |
| C、干冰、钠、冰的熔点依次降低 |
| D、HI、HBr、HCl的熔点依次升高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com