
既可以用来鉴别甲烷和乙烯,又可以用来除去甲烷中混有的少量乙烯的是( )
A.气体通过盛有酸性高锰酸钾溶液的洗气瓶
B.气体通过盛有足量溴水的洗气瓶
C.气体通过盛有足量蒸馏水的洗气瓶
D.气体与适量HCl混合
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是:
A.V3>V2>V1 B.V3=V2=V1 C.V1=V2>V3 D.V3>V2=V1
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化锌是橡胶、油漆、搪瓷、电缆、医药、电子、化学等工业的重要原料。以氧
化锌粗品为原料制备活性氧化锌的生产工艺流程如下:

(1)。浸出”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+、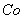 +、Mn2+等
+、Mn2+等
杂质。物质A的作用是调节溶液的pH至5 4,物质A最好选择________。
A.NH3.H2O B.Na2CO3 C. H2SO4 D.ZnO
已知25℃时部分金属离子从开始形成氢氧化物沉淀到沉淀完全时溶液的pH如下表:
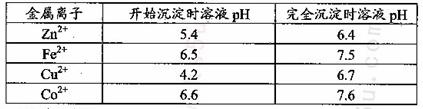
该温度下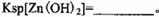 。
。
(2) KMnO4的作用是除去Mn2+和Fe2+,则KMnO4与Mn2+反应的离子方程式为_____________________________________;若溶液中 ,则处理1
,则处理1 该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。
该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。
(3)杂质Cu2+、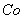 2+可利用置换反应除去,则物质B是_________。
2+可利用置换反应除去,则物质B是_________。
(4)被灼烧的沉淀是 ,生成该沉淀的化学方程式为________。
,生成该沉淀的化学方程式为________。
如何检验该沉淀是否洗净?________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
把a、b、c、d四块金属浸入稀硫酸中,用导线两两相连组成原电池,若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡;b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序为( )
A.a>b>c>d B. a>c>d>b C.c>a>b>d D.b>d>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
下列五种烃:①异戊烷 ②新戊烷 ③丙烷 ④正戊烷 ⑤异丁烷,其沸点按由高到低的顺序排列正确的是( )
A.①②③④⑤ B.②③④⑤①
C.⑤ ② ① ③ ④ D.④ ① ② ⑤ ③
查看答案和解析>>
科目:高中化学 来源: 题型:
元素性质呈周期性变化的决定因素是 ( )
A.元素原子半径大小呈周期性变化 B.元素的相对原子质量依次递增
C.元素原子核外电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
放电
镍氢电池的总反应式是 H2+2NiO(OH) 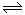 2Ni(OH) 2根据此反应式判断,此电池放电时,在负极上发生反应的物质是 ( )
2Ni(OH) 2根据此反应式判断,此电池放电时,在负极上发生反应的物质是 ( )
A、NiO(OH) B、H2 C、Ni(OH) 2 D、H2和NiO(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
合金与纯金属制成的金属材料相比,优点是 ( )
①合金的硬度一般比它的各成分金属的大
②一般地,合金的熔点比它的各成分金属的更低
③改变原料的配比、改变生成合金的条件,得到有不同性能的合金
④合金比纯金属的导电性更强
⑤合金比纯金属的应用范围更广泛
A.②③④ B.①②③⑤
C.①②④ D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
锌烂板液是制作印刷锌板时用稀HNO3腐蚀锌板后得到的废液,主要含Zn(NO3)2和自来水带进的Cl-、Fe3+等杂质离子。某兴趣小组在实验室中由锌烂板液制取ZnSO4·7H2O的步骤如下:
①在锌烂板液中逐渐加入6 mol/L氢氧化钠溶液,用pH试纸检验,直至pH=8;
②过滤后得到粗Zn(OH)2沉淀,用蒸馏水多次洗涤沉淀;
③用2 mol/L硫酸慢慢将洗净的粗Zn(OH)2沉淀溶解,保持一定pH,加热煮沸,趁热过滤,滤液即为ZnSO4溶液;
④在滤液中注入2 mol/L的硫酸,调节pH为2左右,后经相关操作得到ZnSO4·7H2O晶体。
已知:常温下,Fe3+在pH=1.9开始沉淀,pH=3.2沉淀完全;Zn2+在pH=6.4开始沉淀,pH=8.0沉淀完全;Zn(OH)2的化学性质与Al(OH)3相似。
(1)在以上所有步骤中都需要用到的仪器是烧杯、___________。
(2)步骤②的目的是除去________________等杂质离子,检验沉淀是否已洗净的具体操作是________________。
(3)步骤①保持pH=8的目的是________________,步骤④保持pH =2的目的是________________。
(4)步骤③为了除去Fe3+,故保持的pH范围为_____________,加热煮沸的目的是________________。
(5)步骤④中得到ZnSO4·7H2O晶体的操作步骤为____________、________________、过滤、洗涤、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com