
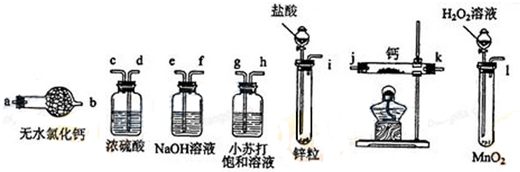
分析 钙属于极活泼的金属,极易与水反应生成氢氧化钙和氢气,而制备的氢气中会混有水蒸气和氯化氢,所以在与钙化合之前需要除杂和干燥,分别选用试剂是氢氧化钠和浓硫酸,同时为防止空气中水蒸气进入,最后还需要连接干燥管,要利用氢气排尽装置中空气,防止钙与氧气等反应.
(1)装有盐酸溶液的仪器为分液漏斗;
(2)产生氢气后应先检验氢气纯度,防止加热时发生爆炸危险,再反应制备氢化钙,冷却后再停止通入氢气;
(3)①氢化钙与水反应生成氢氧化钙与氢气;
②钙能与水反应生成氢氧化钙与氢气;
(4)过氧化钠与水反应生成氧气,氢化钙与水反应生成氢气,检验生成的氢气进行鉴别;
(5)氢化钙是固体,比氢气更易携带,使用也较方便.
解答 解:钙属于极活泼的金属,极易与水反应生成氢氧化钙和氢气,而制备的氢气中会混有水蒸气和氯化氢,所以在与钙化合之前需要除杂和干燥,分别选用试剂是氢氧化钠和浓硫酸,同时为防止空气中水蒸气进入,最后还需要连接干燥管,要利用氢气排尽装置中空气,防止钙与氧气等反应.
(1)装有盐酸溶液的仪器为分液漏斗,
故答案为:分液漏斗;
(2)由于多余的氢气需要燃烧反应掉,先收集一部分气体并检验其纯度,反应结束后还需要使氢化钙在氢气的氛围中冷却,所以应该最后关闭分液漏斗活塞,因此正确的顺序为BADC,
故答案为:BADC;
(3)①氢化钙与水反应生成氢氧化钙与氢气,反应方程式为:CaH2+2H2O=Ca(OH)2+2H2↑,
故答案为:CaH2+2H2O=Ca(OH)2+2H2↑;
②钙能与水反应:Ca+2H2O=Ca(OH)2+H2↑,因此不能根据反应后溶液呈碱性及气泡判断是否含有CaH2,
故答案为:钙能与水反应:Ca+2H2O=Ca(OH)2+H2↑,生成氢气与氢氧化钙,有气泡冒出,溶液中加入 酚酞后显红色;
(4)分别取固体少许与试管中,加入水,用带火星的木条伸入管口,木条复燃的为过氧化钠,另外的固体为氢化钙,
故答案为:分别取固体少许与试管中,加入水,用带火星的木条伸入管口,木条复燃的为过氧化钠,另外的固体为氢化钙;
(5)氢化钙是固体,比氢气更易携带,使用也较方便,
故答案为:氢化钙是固体,携带方便.
点评 本题考查物质制备实验,关键是理解制备原理与各装置作用,注意制备过程中安全性问题,熟练掌握元素化合物性质,难度中等.


科目:高中化学 来源: 题型:选择题
| 实验 序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| 1 | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| 2 | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| 3 | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| A. | 实验1和实验2可以探究Na2S2O3浓度对反应速率的影响 | |
| B. | 实验1和实验3可以探究温度对反应速率的影响 | |
| C. | 通过测定单位时间内收集到气体的体积判断化学反应速率快慢 | |
| D. | 实验3时,应先分别将Na2S2O3溶液、H2SO4溶液和水置于热水浴中加热到所需温度再混合发生反应,记录反应所需时间 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
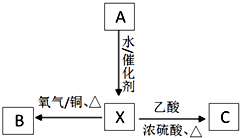 A为标准状况下密度为1.25g•L-1的常见气态烃.有关物质的转化关系如图:请回答:
A为标准状况下密度为1.25g•L-1的常见气态烃.有关物质的转化关系如图:请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
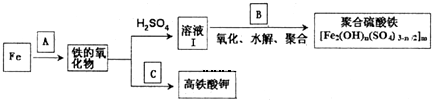
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
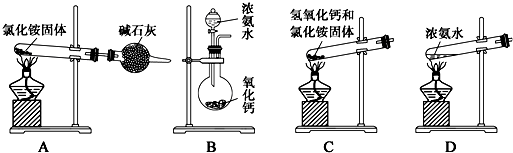
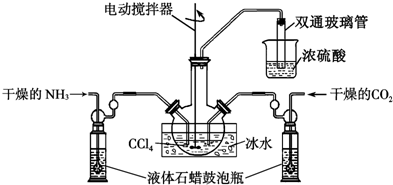
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
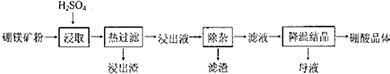
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 | B. | 16 | C. | 24 | D. | 32 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①②⑥ | C. | ④⑤⑦ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 米酒变酸的过程涉及了氧化反应 | |
| B. | 汽油、柴油、植物油都是碳氢化合物 | |
| C. | 含5个碳原子的有机物分子中最多可形成4个碳碳单键 | |
| D. | 蛋白质的水解和油脂的皂化都是由高分子生成小分子的过程 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com