
分析 n(FeSO4)=0.1L×0.01mol/L=0.001mol,根据元素守恒n(FeSO4•7H2O)=n(FeSO4)=0.001mol,故m(FeSO4•7H2O)=0.001mol×278g/mol=0.278g;根据配制步骤是计算、称量(量取)、溶解(稀释)、移液、洗涤、定容、摇匀、装瓶来分析.
解答 解:n(FeSO4)=0.1L×0.01mol/L=0.001mol,根据元素守恒n(FeSO4•7H2O)=n(FeSO4)=0.001mol,
m(FeSO4•7H2O)=0.001mol×278g/mol=0.278g≈0.3g,
配制0.01mol/LFeSO4溶液过程和步骤如下:
①计算;
②称量/量取:称取0.3gFeSO4•7H2O;
③溶解/稀释:将0.3gFeSO4•7H2O放入烧杯中溶解并用玻璃棒不断搅拌;
④移液:待溶液冷却至室温后,将FeSO4•7H2O溶液沿玻璃棒转移至100ml容量瓶中;
⑤洗涤:洗涤烧杯和玻璃棒2~3次,洗涤液也转移至容量瓶;
⑥定容:开始时直接向容量瓶中倒水,至液面离刻度线1~2cm时改用胶头滴管逐滴加入,至凹液面与刻度线相切;
⑦摇匀:用左手压住塞子,将容量瓶倒转过来上下摇动,使溶液均匀;
⑧装瓶:容量瓶不能储存溶液,所以待溶液配制好后,应及时转移至试剂瓶内.
答:需要绿矾的质量是0.3g;配制上述溶液的步骤是计算、称量(量取)、溶解(稀释)、移液、洗涤、定容、摇匀、装瓶.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和步骤,属于基础型题目,难度不大.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:选择题
| A. | 镁与水的反应实验:取一小段镁带,直接投入试管,向试管中加入2ml水并滴入2滴酚酞溶液,加热试管至沸腾,观察到溶液变红 | |
| B. | 为了确定酸碱中和是放热反应,实验中向10ml 2mol/L NaOH溶液中加入浓硫酸至恰好中和,测定出溶液温度升高 | |
| C. | 原电池能将化学能转化为电能:将锌片和铜片用导线连接(导线中间接入一个电流表),平行插入盛有稀硫酸溶液的烧杯中,观察到电流表指针偏转 | |
| D. | 探究不同催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLFeCl3溶液,向第二试管中加入2mL5%H2O2和少量MnO2粉末,不同的催化剂对化学反应速率的影响不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
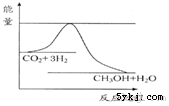 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
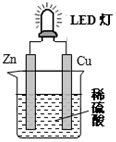
| A. | 锌是负极,电子从锌片经导线流向铜片 | |
| B. | 氢离子在铜片表面被还原 | |
| C. | 装置中存在“化学能→电能→光能”的转换 | |
| D. | 如果将硫酸换成橙汁,导线中不会有电子流动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X可能呈酸性 | B. | X溶液可能呈中性 | C. | Y溶液可能呈中性 | D. | Y溶液一定呈中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com