
一定温度下,在2L密闭容器中发生下列反应:4NO2(g)+O2(g) 2N2O5(g);已知该反应的平衡常数:
2N2O5(g);已知该反应的平衡常数: >
> ,且体系中
,且体系中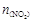 (单位:mol)随时间变化如下表:
(单位:mol)随时间变化如下表:
| 时间(s) | 0 | 500 | 1000 | 1500 |
| t1℃ | 20 | 13.96 | 10.08 | 10.08 |
| t2℃ | 20 | a | b | c |
D
解析试题分析:A.该反应的平衡常数:k300℃>k350℃,温度越大,平衡常数越小,即升高温度,平衡逆向移动,所以正反应为放热反应,故A错误;B.如果t2℃<t1℃,t1℃反应快,先达到平衡,但b与c也不一定相等,而且20-a>a-b,所以a>10+0.5b,故B错误;C.如果t2℃<t1℃,那么t2℃达到平衡的时间应该在t1℃后,但是t1℃达到平衡的时间可能是小于1000s,那么t2℃达到平衡的时间也就不能确定了,故C错误;D.如果t2℃>t1℃,那么t2℃时反应较快,1000s时已经达到了平衡,而且升温时平衡向左移动,n(NO2)>10.8,故D正确;
考点:考查可逆反应在不同温度下达到平衡时各物质的浓度与时间及反应放出或吸收热量的关系的知识。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:单选题
恒温条件下,对于可逆反应A(g)+B(g) C(g)+D(g),加入起始浓度相近的A和B,在达到平衡的过程中可能有三种情况,如下图所示。下列判断中正确的是
C(g)+D(g),加入起始浓度相近的A和B,在达到平衡的过程中可能有三种情况,如下图所示。下列判断中正确的是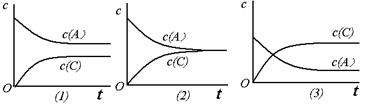
| A.(1)的K<1 | B.(2)的K≈1 | C.(3)的K>1 | D.以上三种可能全对 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
容积均为1L的甲、乙两个恒容容器中,分别充入2molA、2molB和1molA、1molB,相同条件下,发生下列反应:A(g)+B(g) xC(g) △H<〈0。测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是
xC(g) △H<〈0。测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是
A.该反应的x=3
B.此条件下,该反应的平衡常数K=4
C.给乙容器升温可缩短反应达平衡的时间也能提高平衡转化率
D.其他条件不变,向甲容器中再充入0.2 mol C,平衡时A的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)  2Z(g),各组分在不同时刻的浓度如下表:
2Z(g),各组分在不同时刻的浓度如下表:
| 物质 | X | Y | Z |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 2 min末浓度/mol·L-1 | 0.08 | a | b |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定温度下,在2L的密闭容器中发生反应:A(g) + 2B(g) xC(g) △H < 0,B、C的物质的量随时间变化的关系如图所示。下列有关说法不正确的是
xC(g) △H < 0,B、C的物质的量随时间变化的关系如图所示。下列有关说法不正确的是
A.χ=2
B.2min后,降低温度平衡向右移动
C.反应开始2min内ν(C) = 0.1mol/(L·min)
D.当容器内混合气体压强不再改变时,反应体系达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
(14分)乙醇是重要的化工原料和液体燃料,可以在一定条件下利用CO2与H2反应制得:
请回答:
(1)该反应的化学平衡常数表达式为 。
(2)当温度T1>T2时,化学平衡常数K1 K2(填“>”、“<”或“=”)。
(3)在恒温、恒容的密闭容器中,下列描述能说明上述反应已达化学平衡状态的是 (填字母序号)。
a.生成1molCH3CH2OH的同时生成3 mol H2O
b.容器中各组分浓度不随时间而变化
c.容器中混合气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(4)在工业生产中,可使H2的转化率和化学反应速率同时提高的措施有 (写出一条合理措施即可)。
(5)工业上,常以乙醇为原料生产乙醛。根据下图所示信息,该反应是 反应(填“放热”或“吸热”),判断依据是__________________。
(6)乙醇可以作为燃料电池的燃料。某乙醇燃料电池以乙醇为燃料,使用酸性电解质,该电池负极反应的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) △H="74.9" kJ·mol-1,下列说法中正确的是
| A.该反应中熵变、焓变皆大于0 |
| B.该反应是吸热反应,因此一定不能自发进行 |
| C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行 |
| D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 | X | Y | Z |
| 初始浓度(mol/L) | 0.1 | 0.2 | 0 |
| 平衡浓度(mol/L) | 0.05 | 0.05 | 0.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com