
【题目】过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口.回答下列有关双氧水的问题: 
(1)下述反应中,H2O2仅体现氧化性的反应是(填代号) .
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2↑+H2O
C.2H2O2=2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(2)保存过氧化氢的试剂瓶上最适合贴上的一个标签是(填代号).
【答案】
(1)D
(2)B
【解析】解:(1)A.A.Na2O2+2HCl=2NaCl+H2O2 , 是一个非氧化还原反应,双氧水既不是氧化剂,也不是还原剂,故A不选;B.Ag2O+H2O2=2Ag+O2↑+H2O,Ag2O被还原成单质银,H2O2仅表现为还原性,其中氧元素转化为O2 , 故B不C.2H2O2=2H2O+O2↑,过氧化氢的分解反应,是一个自身氧化还原反应,H2O2既表现了氧化性,又表现了还原性,故C不选;D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O,双氧水在反应中化合价由﹣1变成﹣2,化合价降低被还原,双氧水仅做氧化剂,故D选;故答案为:D;(2)过氧化氢为常见的强氧化剂,无毒、不具有腐蚀性,也不自燃,则只有B中标签符合,故答案为:B.
(1)H2O2仅体现氧化性,则O元素的化合价降低;双氧水仅体现还原性,说明双氧水在反应中仅被氧化,化合价只升高;H2O2既体现氧化性又体现还原性,则O元素的化合价既升高又降低;H2O2既不做氧化剂又不做还原剂,说明在反应中双氧水的化合价不发生变化;(2)过氧化氢为常见的强氧化剂.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 石油裂化的目的是为了得到气态短链烃
B. 苯与溴的四氯化碳溶液充分混合仅发生萃取
C. 相同温度下,酯在酸性环境下的水解程度小于碱性环境
D. 煤的干馏是指煤在空气中加强热发生复杂的物理、化学变化的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存利用,常利用NaOH溶液来“捕捉”CO2,过程如图所示(部分条件及物质未标出)。
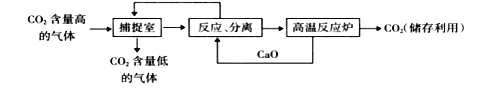
下列说法错误的是
A. 能耗大是该方法的一大缺点
B. “反应、分离”环节中,分离的基本操作是蒸发、结晶
C. 整个过程中,有2种物质可以循环利用
D. “反应、分离”环节中,有复分解反应发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请选择合适方法的填空(用字母序号填空):
A.过滤 B.裂解 C.分馏 D.裂化 E.干馏 F.还原 G.电解 H.蒸发
①从海水中提取粗盐__________________; ②重油转变为汽油_____________;
③石油炼制乙烯、丙烯等__________; ④煤转化为焦炭、煤焦油等____________。
(2)对于容积固定的反应:N2(g)+3H2(g) ![]() 2NH3(g)(正反应放热),达到平衡的标志有__________。
2NH3(g)(正反应放热),达到平衡的标志有__________。
A.N2、H2、NH3 的百分含量不再变化 B.总压强不变
C.N2、H2、NH3 的分子数之比为 1∶3∶2 D.N2、H2、NH3 的浓度相等
E.N2、H2 不再起反应 F.v(N2)=v(H2)
G.混合气体的密度不变 H.混合气体的平均相对分子质量不变
I.正反应放出的热量等于逆反应吸收的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是几种有机物的转换关系,请按要求填空:

已知:A是来自石油的重要有机化工原料,对水果有催熟作用;75%的B可用于医用消毒;E是 具有果香味的有机物,结构简式为C4H8O2;F是一种高聚物,可制成多种包装材料。
(1)G的名称是_____________; F的链节是_____
(2)反应类型:①__________; ③_____
(3)书写反应方程式: ②_____
(4)下列关于 A 和 F 的叙述正确的是_____
A.A 常温下是气体,为纯净物;F 常温下是固体,为混合物
B.A 和 F 都能使酸性高锰酸钾溶液褪色
C.取等质量的 A 和 F 完全燃烧后,生成的 CO2 和 H2O 的质量分别相等
D.取等物质的量的 A 和 F 完全燃烧后,生成的 CO2 和 H2O 的物质的量分别相等
(5)与 E 互为同分异构体,且含有“—COO—”结构的有机物还有____________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组为探究ClO﹣、I2、SO42﹣在酸性条件下的氧化性强弱,已知I2遇淀粉变蓝,设计实验如下:
实验①:在淀粉KI溶液中加入少量NaClO溶液,并加入少量的稀H2SO4 , 溶液立即变蓝;
实验②:向实验①的溶液中加入4L 0.5mol/L的Na2SO3溶液,发生反应如下
SO32﹣+I2+H2O→SO42﹣+I﹣+H+(未配平),恰好完全反应.
(1)以上实验说明,在酸性条件下ClO﹣、I2、SO42﹣的氧化性由弱到强的顺序是
(2)实验②中化学反应转移电子的物质的量是 .
(3)写出实验①中发生反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学反应规律和原理,可以计算所得产物的质量。现有(NH4)2CO3和Ca(HCO3)2的混合物若干,进行下列反应。
(1)取a g该混合物溶于足量水中,写出反应的离子方程式_____________。
(2)取ag该混合物溶于足量水后,若生成沉淀的质量为m g,确定m的取值范围(用含有a的代数式表示,写出计算过程)_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com