
分析 反应①的平衡常数k=c(NH3)•c(HI),NH4I分解生成的HI为平衡时HI与分解的HI之和,即为NH4I分解生成的NH3,由反应②可知分解的c(HI)为平衡时c(H2)的2倍,求出为NH4I分解生成的NH3,代入反应①的平衡常数K=c(NH3)•c(HI)计算.
解答 解:平衡时c(HI)=5mol•L-1,HI分解生成H2的浓度为1mol•L-1,
NH4I分解生成的HI的浓度为:5mol•L-1+2×1mol•L-1=7mol•L-1,所以NH4I分解生成NH3的浓度为7mol•L-1,
所以反应①的平衡常数为:K=c(NH3)•c(HI)=7×5=35,
故答案为:35.
点评 本题考查化学平衡的计算,题目难度不大,正确计算平衡时氨气的浓度为解答关键,注意掌握 化学平衡及其影响,试题培养了学生的分析能力及化学计算能力.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:选择题
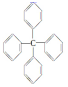 对该分子的描述,不正确的是( )
对该分子的描述,不正确的是( )| A. | 化学式为C25H20 | B. | 所有碳原子都在同一平面上 | ||
| C. | 此分子中有极性键和非极性键 | D. | 此物质属芳香烃类物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
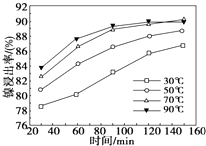 镍及其化合物具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.回答下列问题:
镍及其化合物具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL | B. | 20mL | C. | 360mL | D. | 36mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 假设 | 实验操作 | 现象及结论 |
| 假设1:碳粉可用作还原剂,脱除硝酸盐 | 向烧杯中加入① 碳粉,一段时间后,测定烧杯中NO3-的浓度 | NO3-浓度无明显变化,说明假设Ⅰ不成立 |
| 假设2:碳粉、铁粉形成无数个微小的原电池,促进了硝酸盐的脱除 | 按图示组装实验装置,一段时间后,测定NO3-浓度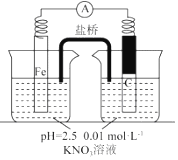 | ② Fe电极部分溶解,电流计指针偏转,说明假设2成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
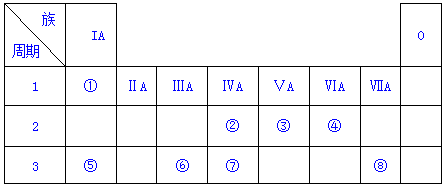
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com