
| 实验序号 |  | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| Ⅰ | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| Ⅱ | 800 | c1 | c2 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
分析 (1)根据浓度变化量之比大于化学计量数之比计算N的浓度;根据v=$\frac{△c}{△t}$计算v(P);
(2)根据浓度变化量之比大于化学计量数之比计算消耗M的浓度,再计算c2;
(3)实验I、Ⅱ平衡时M的浓度相等,二者为完全等效平衡,则起始时M的浓度相等,实验Ⅱ到达平衡时间更短,反应速率快,应是使用催化剂;
(4)M的转化率=$\frac{M的浓度变化量}{M的起始浓度}$×100%.
解答 解:(1)50min时△c(M)=(1-0.5)mol/L=0.5mol/L,则c(N)=$\frac{1}{2}$△c(M)=0.25mol/L,由方程式可知c(P)=c(N)=0.25mol/L,则0~50min内以P的浓度改变表示的反应速率v(P)=$\frac{0.25mol/L}{50min}$=0.005mol/(L.min),
故答案为:0.25;0.005mol/(L.min);
(2)浓度变化量之比大于化学计量数之比,则消耗M的浓度为2×0.10mol•L-1=0.20mol•L-1,则c2=0.5+0.2=0.7,
故答案为:0.7;
(3)实验I、Ⅱ平衡时M的浓度相等,二者为完全等效平衡,则起始时M的浓度相等,则c1=1mol•L-1,实验Ⅱ到达平衡时间更短,反应速率快,应是使用催化剂,
故答案为:1.0;实验Ⅱ使用催化剂;
(4)到达平衡后△c(M)=(1-0.5)mol/L=0.5mol/L,则M的转化率=$\frac{0.5mol/L}{1.0mol/L}$×100%=50%,
故答案为:50%.
点评 本题考查化学平衡有关计算,可以利用平衡常数不变判断实验Ⅱ中M的起始浓度,注意平衡常数的应用.


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:解答题

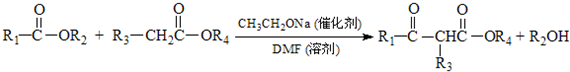
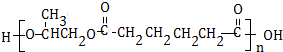 .
.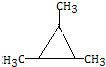 .
.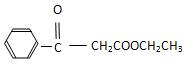
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中C的氢化物稳定性最强 | |
| B. | 同周期元素中A的金属性最强 | |
| C. | 原子半径:A>B,离子半径:A+>C- | |
| D. | A、B、C的简单离子中,会破坏水的电离平衡的是C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
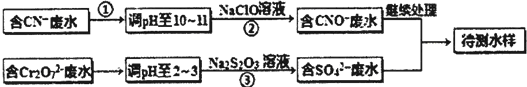
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 目的 | 操作 | |
| A | 干燥Cl2 | 将气体通过盛有碱石灰的干燥装置 |
| B | 检验溴乙烷中的溴元素 | 取样,加NaOH溶液,振荡后再加AgNO3溶液 |
| C | 测定混有NaCl的Na2CO3固体样品中Na2CO3的质量分数 | 取m1g样品加入过量盐酸充分反应,加热蒸干后,称量固体质量为m2 g |
| D | 配制100mL 1.0mol•L-1 CuSO4溶液 | 将25g CuSO4•5H2O溶于100mL蒸馏水中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的原子序数一定为a+2 | |
| B. | Y离子的结构示意图可表示为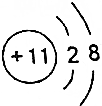 | |
| C. | 若b-a=6.则X和Y形成的化合物一定为离子化合物 | |
| D. | X有可能是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
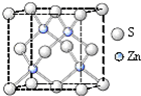 化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑.请根据你所学知识回答:
化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑.请根据你所学知识回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
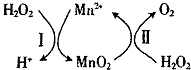 锰的化合物是优良的催化剂,可用于干电池原料生产等.
锰的化合物是优良的催化剂,可用于干电池原料生产等.| t/min | 0 | 2 | 4 | 6 |
| V(O2)mL | 0 | 9.9 | 17.2 | 22.4 |
| 反应 | 平衡常数KP | |
| 773K | 873K | |
| Ⅰ.CO2(g)+4H2(g)?CH4(g)+2H2(g) | 19.4 | 0.803 |
| Ⅱ.CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | 6.07×10-9 | 3.65×10-9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com