
| A. | AlCl3 和NaOH | B. | H2SO4和BaCl2 | C. | NaHCO3和HCl | D. | NaCl和AgNO3 |
分析 A、前者逐滴滴入后者,发生AlCl3+4NaOH═3NaCl+NaAlO2+H2O、3NaAlO2+AlCl3+6H2O═4Al(OH)3↓+3NaCl,
后者逐滴滴入前者发生Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O;
B、H2SO4和BaCl2反应生成硫酸钡沉淀;
C、只发生NaHCO3+HCl═NaCl+CO2↑+H2O;
D、只发生NaCl+AgNO3═NaNO3+AgCl↓.
解答 解:A、因前者逐滴滴入后者,发生AlCl3+4NaOH═3NaCl+NaAlO2+H2O、3NaAlO2+AlCl3+6H2O═4Al(OH)3↓+3NaCl,现象为先没有沉淀后有沉淀生成;
而后者逐滴滴入前者发生Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,现象为先有沉淀生成后沉淀逐渐消失,则现象不同,故A正确;
B、H2SO4和BaCl2反应生成硫酸钡沉淀,无论前者逐滴滴入后者,还是后者逐滴滴入前者,都发生H2SO4+BaCl2═BaSO4↓+2HCl,现象相同,故B错误;
C、无论前者逐滴滴入后者,还是后者逐滴滴入前者,都发生NaHCO3+HCl═NaCl+CO2↑+H2O,现象相同,故C错误;
D、无论前者逐滴滴入后者,还是后者逐滴滴入前者,都发生NaCl+AgNO3═NaNO3+AgCl↓,现象相同,故D错误;
故选A.
点评 本题考查利用滴加顺序不同来判断反应的现象,明确发生的化学反应是解答本题的关键,难度不大.


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
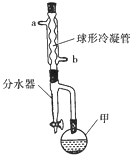 乙酸异戊酯常作为配制香蕉、梨、苹果等多种口味食品的香料.实验室合成乙酸异戊酯的原料是乙酸和异戊醇[(CH3)2CHCH2CH2OH],其装置如图所示.
乙酸异戊酯常作为配制香蕉、梨、苹果等多种口味食品的香料.实验室合成乙酸异戊酯的原料是乙酸和异戊醇[(CH3)2CHCH2CH2OH],其装置如图所示.| 甘油 | 环已烷 | 乙酸 | 异戊醇 | |
| 沸点/℃ | 290 | 80.7 | 117.9 | 132.5 |
| 密度/g•cm-3 | 1.26 | 0.78 | 1.05 | 0.81 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;化合物B2A4的电子式为
;化合物B2A4的电子式为 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(3)为置换反应 | |
| B. | (1)(2)(3)均为氧化还原反应 | |
| C. | (2)为化合反应 | |
| D. | 三个反应的反应物中硅元素均被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用下图表示的一些物质或概念间的从属关系中不正确的是( )
用下图表示的一些物质或概念间的从属关系中不正确的是( )| X | Y | Z | |
| A | 氧化物 | 化合物 | 纯净物 |
| B | 胶体 | 分散系 | 混合物 |
| C | 电解质 | 酸、碱、盐 | 化合物 |
| D | 碱性氧化物 | 金属氧化物 | 氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3 溶液 | B. | NaOH溶液 | C. | Ba(OH)2溶液 | D. | 盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com