
| A. | CuSO4 | B. | CuO | C. | CuSO4•5H2O | D. | Cu(OH)2 |
科目:高中化学 来源: 题型:选择题
| A. | NH3的熔、沸点比第ⅤA族其他元素氢化物的熔、沸点高 | |
| B. | 乙酸可以和水以任意比互溶 | |
| C. | 常温下H2O为液态,而H2S为气态 | |
| D. | 水分子高温下也很稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓盐酸与铁屑反应的离子方程式:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 钠与CuSO4溶液反应的离子方程式:2Na+Cu2+═Cu↓+2Na+ | |
| C. | NaHCO3溶液与NaOH反应的离子方程式:HCO3-+OH-═H2O+CO2↑ | |
| D. | 将CO2通入饱和碳酸钠溶液直至过量的离子方程式:2Na++CO2+CO32-+H2O═2NaHCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
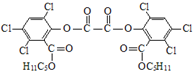 “魔棒”常用于晚会气氛的渲染,其发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后发光.草酸二酯(CPPO)结构简式如下图所示,请回答下列问题:
“魔棒”常用于晚会气氛的渲染,其发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后发光.草酸二酯(CPPO)结构简式如下图所示,请回答下列问题: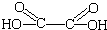 ).
).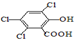 )在催化剂和适当条件下可以生成CPPO,
)在催化剂和适当条件下可以生成CPPO,| 实验序号 | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(s) 质量(g) | 褪色时间(S) | ||
| C(mo•L-1) | V(mL) | C(mol•L-1) | V(mL) | |||
| 实验1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
| 实验2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
 .类似的
.类似的 ,也可以发生反应生成N,则N结构简式为
,也可以发生反应生成N,则N结构简式为 (写出其中的一种).
(写出其中的一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期元素T、Q、R、W、Z在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素T、Q、R、W、Z在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质的溶液导电能力强于弱电解质的溶液 | |
| B. | CO2的水溶液可以导电,所以CO2是电解质 | |
| C. | 所有盐均电离出金属阳离子和酸根离子 | |
| D. | 电离时生成的阳离子全部是氢离子的化合物叫做酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
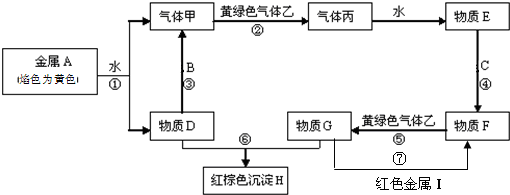
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com