
【题目】某班化学兴趣小组做如下实验,请你回答相关问题:
Ⅰ、甲组同学想用金属钠和空气制备纯度较高的Na2O2(不考虑空气中N2),可利用的装置如下。回答下列问题:
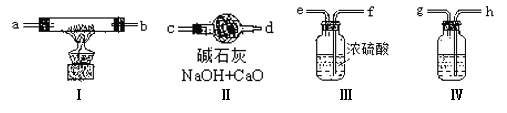
(1)装置Ⅳ中盛放的药品是 ,若没有该装置可能导致生成的Na2O2中含有 ,其反应方程式为 。
(2)若规定气体的气流方向从左到右,各仪器接口的标号字母(a、b……)顺序是:
空气进入 , 接 , 接 , 接 。
(3)装置的Ⅱ作用是 。
Ⅱ、乙组利用下图所示实验装置进行某些气体的制备、性质等试验(图中夹持装置有省略)。
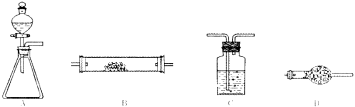
(4)为验证氯气不能使干燥的红布条褪色,置红布条于B中,按A-C-B-D连接成实验装置体系。A锥形瓶中试剂选用高锰酸钾晶体,则分液漏斗中的液体是 ;A中发生的化学方程式是 ,C中试剂是 ,D的作用是 。
【答案】(14分)(1)NaOH溶液(1分),Na2CO3(1分),2Na2O2+2CO2==2Na2CO3+O2↑(2分)
(2)h g f e a b c(2分)
(3)防止空气中的水分和二氧化碳倒吸进入装置Ⅰ(2分)
(4)浓盐酸(1分)(填“盐酸”可得分)
2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O(2分)(化学式写错、未配平均不得分。条件漏写扣1分。)浓硫酸(1分)吸收氯气以免污染环境(2分)(填“除去氯气”等合理答案可得分。)
【解析】
试题分析:(1)装置Ⅳ是利用NaOH溶液除去空气中的二氧化碳,若没有该装置,空气的CO2和Na2O2反应会生成碳酸钠,发生反应方程式为2Na2O2 +2CO2 == 2Na2CO3 + O2↑;
(2)依据上述分析确定连接顺序,组合实验装置时各仪器的正确连接顺序为Ⅳ、Ⅲ、Ⅰ、Ⅱ,根据气流方向各接口的连接顺序为h g f e a b c;
(3)利用装置Ⅱ中有碱石灰防止空气中的水分和二氧化碳倒吸进入装置Ⅰ;
(4)高锰酸钾和浓盐酸制备氯气,因此分液漏斗中为浓盐酸,发生反应的化学方程式为2KMnO4 + 16HCl(浓) = 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O;氯气和水能反应生成HClO,HClO能使有色布条褪色,因此需要用浓硫酸干燥氯气;氯气有毒,不能直接排放到大气中,所以装置D是用于吸收氯气,以免污染环境。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】现代传感信息技术在化学实验中有广泛的应用。某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(如图1 所示),并测定电离平衡常数Kb。

(1)实验室制取氨气的化学方程式为_____________;
图1 中用浓氨水和X 固体快速制取NH3,X固体不可以是________(填序号)
A.生石灰 B.无水氯化钙 C.烧碱 D.碱石灰
(2)关闭a,将带有装满水的胶头滴管的橡皮塞塞紧c 口,_______(填操作)可引发喷泉实验,电脑绘制三颈瓶内气压变化曲线如图2 所示。图2中________点时喷泉喷的最剧烈。
(3)喷泉实验结束后,发现水未充满三颈烧瓶(大约占体积的90 % ) ,如装置的气密性良好,烧瓶未充满水的原因是________________,所得氨水的物质的量浓度为________。
(4)从三颈瓶中用__________(填仪器名称)量取25. 00 mL氨水至锥形瓶中,用0.0500mol/LHCl 滴定测定氨水的浓度。用pH 计采集数据、电脑绘制滴定曲线如图3 所示。

当pH=11.0时,NH3·H2O电离平衡常数Kb的近似值,Kb≈_________。
(5)关于该滴定实验的说法中,正确的是_______(填序号)
A. 锥形瓶中有少量蒸馏水不影响测定结果
B.选择酚酞作为指示剂,测定结果偏高
C.酸式滴定管未用盐酸润洗会导致测定结果偏低
D.滴定终点时俯视读数会导致测定结果偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“神十搭载的长征F改进型火箭推进剂之一为无色气体N2O4,N2O4与NO2转换的热化学方程式为:N2O4(g)![]() 2NO2(g) △H=+24.4KJ/mol
2NO2(g) △H=+24.4KJ/mol
(1)将一定量N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是 。
a.v正(N2O4)=2v逆(NO2) b.体系颜色不变
c.气体平均相对分子质量不变 d.气体密度不变
达到平衡后,保持体积不变升高温度,再次到达平衡时,则混合气体颜色 (填“变深”、“变浅”或“不变”),判断理由 。
(2)T℃时,向1L恒容密闭容器中投入1molCH4和1molH2O(g),发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),经过3min,反应达到平衡。已知平衡时c(CH4)=0.5mol/L
CO(g)+3H2(g),经过3min,反应达到平衡。已知平衡时c(CH4)=0.5mol/L
①0~3min内,该反应的平均反应速率v(H2)=____________。
②T℃时,该反应的平衡常数K=___________。
(3)在一定条件下用CO和H2可以制得甲醇,CH3OH和CO的燃烧热为别725.8 kJ/mol ,283.0 kJ/mol,1 mol液态水变成气态水吸热44.0 kJ,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式: 。
(4)工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)![]() CH3OH(g)。按n(CO) : n(H2)=1 : 2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。
CH3OH(g)。按n(CO) : n(H2)=1 : 2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。
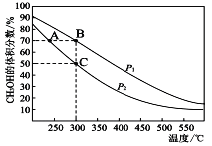
P1_________P2(填“<”“>”或“=”)
②在C点时,CO转化率为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有K+, Fe3+, Cl-,SO42-四种离子,已知K+, Fe3+, Cl-的个数比为3:2:1。则溶液中Fe3+与SO42-离子的个数比为( )
A. 1:2 B. 1:4 C. 3:4 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电子构型的原子中,第二电离能与第一电离能相差最大的是( )
A. 1s22s22p5 B. 1s22s22p6 C. 1s22s22p63s1 D. 1s22s22p63s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴加新制氯水后,下列各组离子可能大量存在的是
A. Fe3+、Al3+、Cl-、NO3- B. K+、Na+、I-、SO42-
C. Ag+、Ca2+、NH4+、NO3- D. Na+、Ba2+、CO32-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:可逆反应N2(g)+3H2(g)![]() 2NH3(g)△H<0。现有甲、乙两个容积相同且不变的真空密闭容器,向甲容器中加入1molN2(g)和3molH2(g),在一定条件下发生反应,达到平衡时放出热量为Q1kJ。在相同条件下,向乙容器中加入2molNH3(g)并发生反应,达到平衡时吸收热量为Q2kJ,若Q1=3Q2。下列叙述中正确的是
2NH3(g)△H<0。现有甲、乙两个容积相同且不变的真空密闭容器,向甲容器中加入1molN2(g)和3molH2(g),在一定条件下发生反应,达到平衡时放出热量为Q1kJ。在相同条件下,向乙容器中加入2molNH3(g)并发生反应,达到平衡时吸收热量为Q2kJ,若Q1=3Q2。下列叙述中正确的是
A.达平衡时甲中NH3的体积分数为75%
B.达平衡时甲、乙中NH3的体积分数乙>甲
C.达到平衡后,再向乙中加入0.25molN2(g)、0.75molH2(g)和1.5molNH3(g),平衡向生成NH3的方向移动
D.乙中反应的热化学方程式为2NH3(g)![]() N2(g)+3H2(g);△H=+Q2kJ/mol
N2(g)+3H2(g);△H=+Q2kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com