
| A | B | C | D | |
| 气体 | CO2 | HCl | HCl | SO2 |
| 液体 | H2O | NaOH | H2O | NaOH |
| A. | A | B. | B | C. | C | D. | D |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
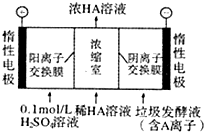 对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一.
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾--Al2(SO4)3•12H2O | B. | 漂白粉--NaClO | ||
| C. | 苏打粉--NaHCO3 | D. | 水煤气--CO、H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 mL | B. | 7.5 mL | C. | 15 mL | D. | 22.5 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.1 | 11.6 | 10.3 | 11.1 | 11.3 |
| A. | CO2+H2O+2NaClO═Na2CO3+2HClO | B. | CO2+H2O+NaClO═NaHCO3+HClO | ||
| C. | CO2+H2O+C6H5ONa-→NaHCO3+C6H5OH | D. | CH3COOH+NaCN═CH3COONa+HCN |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na2O2+2Mn2O7→4NaMnO4+O2↑ | B. | 2Na2O2+P2O3→Na4P2O7 | ||
| C. | 2Na2O2+2 N2O3→NaNO2+O2↑ | D. | 2 Na2O2+2 N2O5→4NaNO3+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 111 | B. | 112 | C. | 113 | D. | 114 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com