
 化学在能源开发与利用中起着十分关键的作用.
化学在能源开发与利用中起着十分关键的作用.| 金属 | 电子流动方向 | 电压/V |
| A | A-→Fe | +0.76 |
| B | Fe-→B | -0.18 |
| C | C-→Fe | +1.32 |
| D | D-→Fe | +0.28 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、v(NH3)=0.17g?L-1?s-1 |
| B、v(NH3)=0.02mol?L-1?min-1 |
| C、v(N2)=0.01mol?L-1?min-1 |
| D、v(H2)=0.015mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
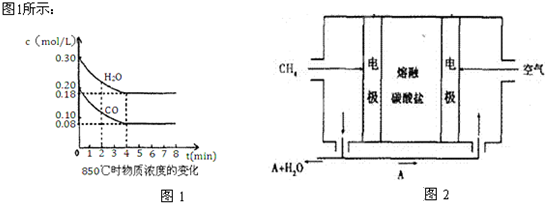
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ||||||||
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 四 | ⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com