
| A. | LiAlH4中H元素的化合价为-1 | |
| B. | LiAlH4L、iAlO2、LiH均是离子化合物 | |
| C. | 1mol LiAlH4在125℃完全分解,转移4mol电子 | |
| D. | 0.5 mol LiAlH4与水充分反应后产生44.8L H2 |
分析 A.根据化合物中化合价的代数和为零分析;
B.活泼金属与活泼非金属元素间一般形成离子键;
C.LiAlH4在125℃分解为LiH、H2和Al,Al由+3价降低为0;
D.没有说明是标准状况下,无法计算体积.
解答 解:A.LiAlH4中Li为+1价,Al为+3价,则H元素的化合价为-1,故A正确;
B.活泼金属与活泼非金属元素间一般形成离子键,则LiAlH4、LiAlO2、LiH中均含有离子键,属于离子化合物,故B正确;
C.LiAlH4在125℃分解为LiH、H2和Al,Al由+3价降低为0,则1mol LiAlH4在125℃完全分解,转移3mol电子,故C错误;
D.没有说明是标准状况下,无法计算氢气的体积,故D错误.
故选:CD.
点评 本题考查氧化还原反应,为信息型习题,注意信息与氧化还原反应知识的结合来解答,考查学生知识迁移应用的能力,题目难度中等.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | 用溶解、过滤的方法提纯含有少量碳酸镁的氢氧化镁 | |
| B. | 向混有乙酸的乙酸乙酯中加入NaOH溶液再分液提纯乙酸乙酯 | |
| C. | 除去FeCl2中少量的FeBr2:加入适量氯水,在加四氯化碳萃取、分液 | |
| D. | 向AlCl3溶液中滴加氨水,产生白色沉淀,再加入NaHSO4溶液,沉淀消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
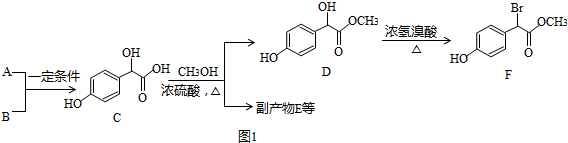
 ;
;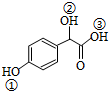 )中①、②、③3个-OH的酸性由强到弱的顺序是③>①>②;
)中①、②、③3个-OH的酸性由强到弱的顺序是③>①>②; .
.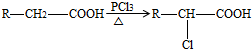

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
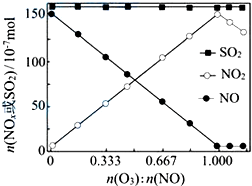 烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量;O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量;O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

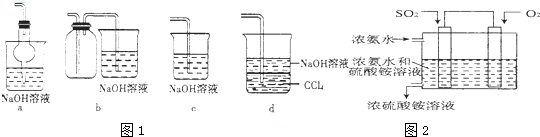
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 28g乙烯(C2H4)和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| C. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 |  |  | 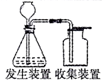 |
| ① | ② | ③ | ④ |
| A. | 装置①可用于模拟氯碱工业生产氯气 | |
| B. | 装置②的原理可用于潮汐能发电站钢阀门的保护 | |
| C. | 装置③可用于食盐水的蒸发结晶 | |
| D. | 装置④可用于二氧化锰与浓盐酸反应制取氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
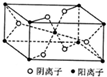 X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;Z基态原子的M层与K层电子数相等;R2+的3d轨道有9个电子.
X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;Z基态原子的M层与K层电子数相等;R2+的3d轨道有9个电子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纳米碳酸钙材料能够产生丁达尔效应 | |
| B. | NOx、SO2、PM2.5颗粒都会导致酸雨 | |
| C. | 纯碱可用于制造玻璃,也可用于除去物品表面的油污 | |
| D. | 糖类、油脂、蛋白质均能发生水解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com