
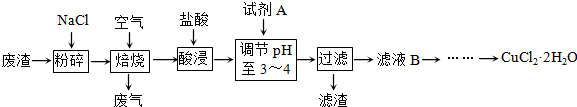
| ||
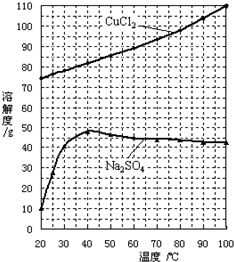
| ||


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
| A、标况下,11.2 L氯气完全溶于1 L水中,所得溶液中Cl-和ClO-两种粒子数之和为NA |
| B、80mL 10mol?L-1 盐酸与足量MnO2加热反应,产生Cl2分子数为0.2NA |
| C、含有4 NA个碳碳σ键的金刚石,其质量为24 g |
| D、含0.1 mol FeCl3的溶液完全水解后得到的胶体粒子个数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/mol?L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a.实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和 c.实验①和 |
| ② | ||||
| ③ | ||||
| ④ |
| 实验编号 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| ① | 14.0 | 13.0 | 11.0 |
| ② | 6.0 | 7.0 | 7.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中无法确定Al3+的存在与否 |
| B、原溶液中不含的离子为:K+、Al3+、CO32- |
| C、步骤②中可以确定Fe2+、NO3-的存在 |
| D、步骤③中共有2种钡盐沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-1076.7 kJ/mol | ||||
B、N2H4(g)+
| ||||
| C、2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-542.7 kJ/mol | ||||
| D、2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-1059.3 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气体中一定有甲烷 |
| B、混合气体一定是甲烷和乙烯 |
| C、混合气体中一定没有乙炔 |
| D、混合气体中一定有丙炔 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com