
 As、N、0等非金属元素的化合物在工业生产中有重要的应用.
As、N、0等非金属元素的化合物在工业生产中有重要的应用.分析 (1)核电荷数比As小4的原子为Cu,其原子核外有29个电子,根据构造原理书写其基态原子核外电子排布式;
(2)按照从第一到第四周期的顺序,根据元素周期表中各元素结构及未成对电子数进行解答;
(3)氮的最高价氧化物为N2O5,由两种离子构成,其中阴离子构型为平面正三角形,化学式应为NO3-,则其阳离子的化学式为:NO2+,根据N原子的价层电子对数判断杂化类型;
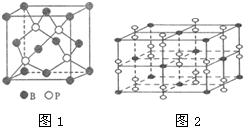
(4)根据磷化硼分子的分子结构图分析;
(5)根据原子之间存在的化学键知,黑色小球表示Ca原子,白色小球表示O原子,该晶胞中Ca原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,O原子个数=(1+12×$\frac{1}{4}$)×2=8,其化学式为Ca、O原子个数最简比;
根据ρ=$\frac{m}{V}$=$\frac{\frac{M}{{N}_{A}}}{V}$得晶胞边长=$\root{3}{\frac{4M}{ρ{N}_{A}}}$,晶胞中离得最近的两个钙离子间的距离是该晶胞边长的$\frac{\sqrt{2}}{2}$倍.
解答 解:(1)核电荷数比As小4的原子为Cu,其原子核外有29个电子,基态的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1;
故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1;
(2)第一周期中,有1个未成对电子的是氢原子,其电子排布式为1s1;第二周期中,未成对电子是2个的有两种分别为:C:1s22s22p2和O:1s22s22p4;第三周期中,未成对电子是3个的是P:1s22s22p63s23p3;第四周期中未成对电子是4个的是Fe:1s22s22p63s23p63d64s2,
故答案为:5;
(3)氮的最高价氧化物为N2O5,由两种离子构成,其中阴离子构型为平面正三角形,化学式应为NO3-,则其阳离子的化学式为:NO2+,其中心原子价电子对数为:2+$\frac{5-1-2×2}{2}$=2,所以其中的氮原子按sp方式杂化,阳离子的构型为直线型,
故答案为:直线; sp;
(4)磷化硼晶体中存在分子,则氮化硼属于分子晶体,根据分子结构图可知,其分子式为:B14P4;
故答案为:B14P4;
(5)根据原子之间存在的化学键知,黑色小球表示Ca原子,白色小球表示O原子,该晶胞中Ca原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,O原子个数=(1+12×$\frac{1}{4}$)×2=8,该晶胞中Ca、O原子个数之比=4:8=1:2,则化学式为CaO2;
根据ρ=$\frac{m}{V}$=$\frac{\frac{M}{{N}_{A}}}{V}$得晶胞边长=$\root{3}{\frac{4M}{ρ{N}_{A}}}$=$\root{3}{\frac{4×72}{ρ{N}_{A}}}$cm,晶胞中离得最近的两个钙离子间的距离是该晶胞边长的$\frac{\sqrt{2}}{2}$倍,则晶胞中离得最近的两个钙离子间的距离为$\root{3}{\frac{4×72}{ρ{N}_{A}}}$×$\frac{\sqrt{2}}{2}$=$\frac{\sqrt{2}}{2}•\root{3}{\frac{4×72}{ρ{N}_{A}}}$cm;
故答案为:CaO2;$\frac{\sqrt{2}}{2}•\root{3}{\frac{4×72}{ρ{N}_{A}}}$.
点评 本题考查了核外电子排布、分子构型和杂化方式、晶胞的计算等内容,综合性较强,难度中等,解题的关键要充分用好立体几何的知识,发挥空间想象力,解决问题.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 物质的量/mol 时间 | n (N2H4) | n (NO2) | n (N2) |
| 起始 | 2.0 | 3.0 | 0 |
| 第2min | 1.5 | a | 0.75 |
| 第4min | 1.2 | b | 1.2 |
| 第6min | 1.0 | c | 1.5 |
| 第7min | 1.0 | c | 1.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将PH=1的醋酸和PH=13的Na OH溶液混合后,若c(CH3COO-)=c(Na+),则溶液显中性 | |
| B. | 在Na2SO3溶液中:c(Na+)=2c(SO32-)+c(HSO3-)+c(OH-) | |
| C. | pH=6的CH3COOH溶液和pH=6的NH4Cl溶液,由水电离出的c(H+)均为1×10-8mol•L-1 | |
| D. | 在饱和Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鸡蛋和牛奶都含有大量蛋白质,可以在微波炉中加热牛奶和完整的鸡蛋 | |
| B. | 炒菜时油锅着火可以迅速盖上锅盖 | |
| C. | 天然气、沼气主要成分是甲烷,液化石油气的主要成分是丙烷、丁烷等 | |
| D. | 桌台抹布上有很多油污,放进沸水中并加少量纯碱煮几分钟会变得很干净 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
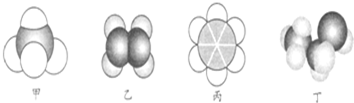
| A. | 22.4 L甲中含有10 mol电子 | |
| B. | 乙与乙的加聚产物都能使溴水褪色 | |
| C. | 丙不能与溴水、酸性高锰酸钾溶液发生反应 | |
| D. | 丙、丁都可以萃取溴水中的溴单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L一氯甲烷和二氯甲烷的混合物中所含的氯原子数介于NA至2NA之间 | |
| B. | 0.1 mol Cu与足量热的浓硫酸反应生成SO2的体积约为22.4 L | |
| C. | 0.2 mol•L-1 Na2S溶液中含有的S2-数目小于0.2NA | |
| D. | 在反应Zn+2HNO3+NH4NO3═N2↑+3H2O+Zn(NO3)2中每溶解1 mol Zn,转移的电子数大于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LSO3所含电子数约为40 NA | |
| B. | 0.5 mol NH4HSO4晶体中,含有H+数目约为0.5 NA | |
| C. | 92 g NO2、N2O4混合气体含有的N原子数为2NA | |
| D. | 1 mol Cl2作为氧化剂得到的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1CH3COONa溶液与0.1mol•L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 某温度下,KSP(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12;将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液,则先产生Ag2CrO4沉淀 | |
| C. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| D. | 在0.1 mol•L-1氨水中滴加0.1 mol•L-1盐酸,刚好完全中和时pH=a,则由水电离产生的c(H+)=10-amol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂是油和脂肪的统称,都是高级脂肪酸与甘油形成的酯 | |
| B. | 棉花、羊毛、蚕丝和麻等是天然纤维 | |
| C. | 高聚物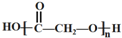 中的官能团是酯基 中的官能团是酯基 | |
| D. | 可以用溴水鉴别乙醛和乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com