
| A. | ①③④ | B. | ①③ | C. | ②④⑥ | D. | ②⑤⑥ |
分析 能够减慢反应速率,可使氢离子浓度降低,又不影响产生H2总量,则氢离子的总物质的量不变,以此解答该题.
解答 解:①加入醋酸钠固体,氢离子浓度降低,反应速率减小,但生成氢气的总量不变,故正确;
②加入Na2CO3晶体,消耗盐酸,生成氢气的总量减少,故错误;
③加入氯化钠溶液,溶液体积增大,氢离子浓度降低,反应速率减小,但生成氢气的总量不变,故正确;
④加入铁粉,形成原电池反应,反应速率增大,故错误;
⑤加入浓盐酸,反应速率增大,生成氢气的总量增多,故错误;
⑥加入NaOH晶体,氢离子浓度降低,反应速率减小,但生成氢气的总量也减少,故错误.
故选B.
点评 本题考查化学反应速率的影响因素,为高考高频考点,注意题目的要求,答题时注意审题,难度不大,注意相关基础知识的积累.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:解答题
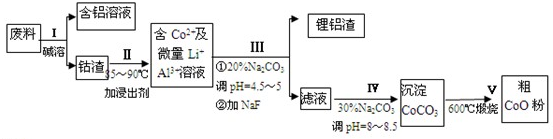
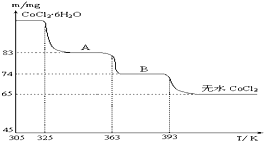
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24 L CO2中含有原子数为0.3NA | |
| B. | 25℃,pH=13的NaOH溶液中含有OH-为0.1NA | |
| C. | 一定条件下,4.6 g NO2和N2O4混合气体中含有的N原子数目为0.1NA | |
| D. | 1L0.1molL-1的氨水中有NA个NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3能与酸反应,但不能与碱反应 | |
| B. | FeO在空气中受热,会被氧化为Fe3O4 | |
| C. | Na2O2既有氧化性又有还原性,故Na2O2属于两性氧化物 | |
| D. | Na2O和Na2O2中阴、阳离子个数之比分别为1:2 和1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
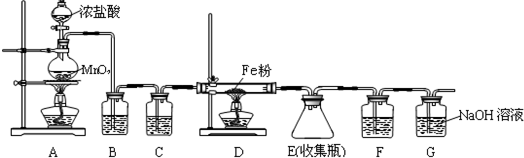
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
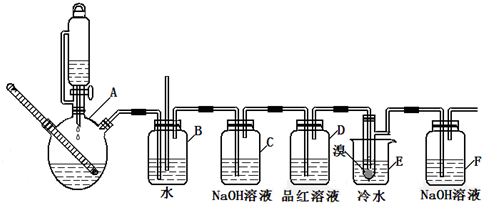
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com