
A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A _________ D __________
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________,碱性最强的是_________。
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________,电负性最大的元素是__________。
(4)D的氢化物比C的氢化物的沸点__________(填"高"或"低"),原因_____________
(5)A、B、C最高价氧化物的晶体类型分别是______晶体、______晶体、______晶体
(6)画出D的核外电子排布图___________________________________________,这样排布遵循了___________原理和____________规则。
(1)Si、N (2) HNO3、NaOH (3) F F
(4)高,因为NH3分子间形成氢键 (5)原子、离子、分子
(6)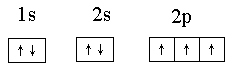 ;泡利,洪特
;泡利,洪特
【解析】根据A的原子结构示意图可知,A是Si,属于第三周期。第三周期周期第一电离能最小的元素是Na,所以B是钠。C的最外层有三个成单电子,且C是第三周期,所以C是P。C、D同主族,因此D是N。E的外围电子排布式为3d64s2,所以E是铁。
(2)氮的非金属性最强,所以硝酸的酸性最强。钠的金属性最强,因此氢氧化钠的碱性最强。
(3)非金属性越强,第一电离能和电负性越大,氟是最强的非金属元素,所以F的第一电离能和电负性都是最大的。
(4)氨气中存在氢键,所以沸点高于PH3的。
(5)A、B、C最高价氧化物分别是SiO2、Na2O、P2O5,晶体类型分别是原子晶体、离子晶体和分子晶体。
(6)因为全充满或半充满是最稳定的,所以电子排布图为


科目:高中化学 来源: 题型:
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
 Al(OH)3+OH-
Al(OH)3+OH- Al(OH)3+OH-
Al(OH)3+OH-查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为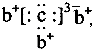 下列比较中正确的是( )
下列比较中正确的是( )| A、原子半径:a>c>d>b | B、最高价含氧酸的酸性c>d>a | C、原子序数:a>d>b>c | D、单质的氧化性a>b>d>c |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com