
| A. | 钠质软,可用小刀切割 | |
| B. | 钠要保存在煤油或者石蜡油中 | |
| C. | 钠着火可用干沙扑灭 | |
| D. | 钠与氧气反应,产物是由氧气的量决定的 |
分析 A.钠较软,易切割;
B.钠能与空气中的水和氧气发生还原反应反应;
C.钠着火时生成过氧化钠,而过氧化钠能与水、二氧化碳发生反应生成氧气,不能使用水、干粉灭火器等来扑灭;
D.钠在没有条件下和氧气反应生成氧化钠,在点燃条件下,和氧气反应生成淡黄色的过氧化钠.
解答 解:A.钠的质地柔软,能用小刀切割,故A正确;
B.钠能与空气中的水和氧气发生还原反应反应,故钠保存在石蜡油或煤油中,故B正确;
C.钠着火时生成过氧化钠,而过氧化钠能与水、二氧化碳发生反应生成氧气,可用干燥沙土隔绝空气扑灭,故C正确;
D.钠在没有条件下和氧气反应生成氧化钠,在点燃条件下,和氧气反应生成淡黄色的过氧化钠,与条件有关,故D错误;
故选D.
点评 本题考查钠的物理和化学性质,学生要熟记钠的物理性质和钠的化学性质,钠的结构中最外层只有一个电子,表现为失电子,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 因SiO2不溶于水,故H2SiO3不是SiO2对应的酸或者SiO2不是H2SiO3的酸酐 | |
| B. | CO2通入水玻璃,可以得到硅酸沉淀 | |
| C. | SiO2是一种空间立体网状结构的晶体,熔点高,硬度大 | |
| D. | 氢氟酸能够腐蚀玻璃,故不能用玻璃瓶来装氢氟酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P1=2P2 | B. | 2P1=P2 | C. | P1<P2<2P1 | D. | 2P1<P2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
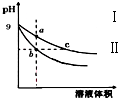 常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述正确的是( )
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述正确的是( )| A. | b、c两点溶液的导电能力相同 | |
| B. | a、b、c三点溶液中水的电离程度a>c>b | |
| C. | c点溶液中c (H+)=c (OH-)+c (CH3COOH) | |
| D. | 用等浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸体积 Vb=Vc |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
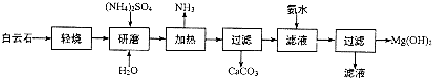
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
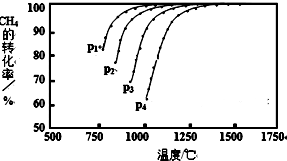
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
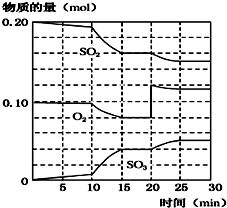
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
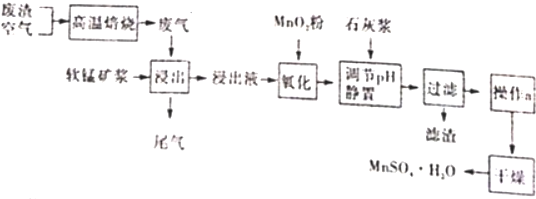
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com