
| A、① | B、②③ | C、②③④ | D、①④ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
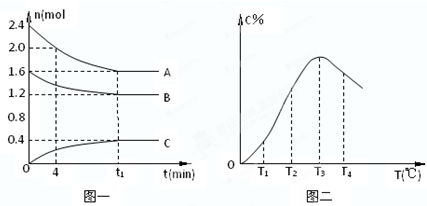
| A、0~4分钟时,A的速率为0.01mol/(L?min) | ||
| B、由T1向T2变化时,V正>V | ||
C、该反应的平衡常数表达式K=
| ||
| D、此反应的正反应为吸热反应. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
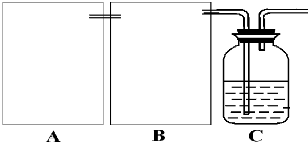
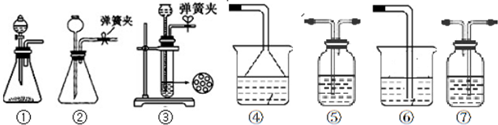
查看答案和解析>>
科目:高中化学 来源: 题型:
| 检测结果 | |
| 甲 | KCl、K2SO4、Na2CO3、NaCl |
| 乙 | KCl、BaCl2、Na2SO4、K2CO3 |
| 丙 | Na2SO4、KCl、K2CO3、NaCl |
| 丁 | KCl、CuSO4、Na2CO3、NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
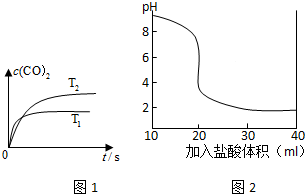
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、NH4+、MnO4-、SO42- |
| B、K+、Na+、AlO2-、NO3- |
| C、NH4+、Al3+、SO42-、NO3- |
| D、Na、K+、NO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L该溶液中含硝酸钾 202 g |
| B、100mL该溶液中含硝酸钾 0.02 mol |
| C、从1L该溶液中取出 500 mL 后,剩余溶液的浓度为 0.1mol/L |
| D、1L水中溶解 0.2 mol 硝酸钾,即可配得0.2 mol/L硝酸钾溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com