
| A、常温下,CH3COONa和CH3COOH混合溶液pH=7,且c(Na+)=0.1mol?L-1:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
| B、在0.1mol?L-1 Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
| C、向0.2mol?L-1 NaHCO3溶液中加入等体积0.1mol?L-1 NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、在0.1mol?L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |


科目:高中化学 来源: 题型:
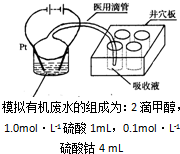 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题.查看答案和解析>>
科目:高中化学 来源: 题型:
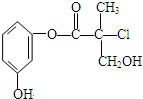 某有机物A是农药生产中的一种中间体,其结构简式如下图.则下列叙述正确的是( )
某有机物A是农药生产中的一种中间体,其结构简式如下图.则下列叙述正确的是( )| A、有机物A属于芳香烃 |
| B、1molA和足量的NaOH溶液反应,最多可以消耗4mol NaOH |
| C、有机物A和浓硫酸混合加热,可以发生消去反应 |
| D、有机物A可以和Br2的CCl4溶液发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、阳极上的电极反应均为2Cu-2e-+2OH-═Cu2O+H2O |
| B、工作过程中两个装置内溶液的pH均减小 |
| C、两个装置内阴离子均移向铜电极 |
| D、阴极上开始时均有氢气生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制100mL 1.0mol/L CuSO4溶液,可将25g CuSO4?5H20溶于100mL蒸馏水中 |
| B、将几根火柴头浸于水中,一段时间后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液,若出现白色沉淀,说明含有氯元素 |
| C、用纸上层析法分离某些物质时,为了看到色斑,只有有色离子的物质才可以用纸层析法 |
| D、减压过滤时,吸滤瓶内液面高度将达到支管口时,应拔掉吸滤瓶上的橡皮管,并从吸滤瓶支管口倒出溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是甲醇/过氧化氢燃料电池内部结构示意图.工作时,甲醇和过氧化氢分别进入燃料电池的燃料腔和氧化剂腔,在各自催化剂的作用下发生反应,并向外界输出电能.下列说法不正确的是( )
如图是甲醇/过氧化氢燃料电池内部结构示意图.工作时,甲醇和过氧化氢分别进入燃料电池的燃料腔和氧化剂腔,在各自催化剂的作用下发生反应,并向外界输出电能.下列说法不正确的是( )| A、该电池的正极反应式:H2O2+2H++2e-═2H2O |
| B、燃料腔中的多孔石墨电极为该燃料电池的负极,负极产生的H+通过质子交换膜流向正极 |
| C、电池工作时,1mol甲醇被氧化有6 mol电子转移 |
| D、电路中的电子经正极、负极、质子交换膜后再回到正极,形成闭合回路 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 |
| B、常用的自来水消毒剂有氯气和二氧化氯,两者都含有极性键 |
| C、在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
| D、在车排气管上加装“催化转化器”是为了减少有害气体的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、8种 | B、16种 |
| C、24种 | D、28种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com