
 己知A、B、C、D、E五种元素,均位于周期表的前四周期,它们的核电荷数依次增加.A元素核内只有质子,B原子的L层p轨道中有2个电子,C的原子核外有三个未成对电子,D原子核外电子排布为nsnnpn+2,E是第四周期元素,最外层只有一个电子,其余各层电子均充满.
己知A、B、C、D、E五种元素,均位于周期表的前四周期,它们的核电荷数依次增加.A元素核内只有质子,B原子的L层p轨道中有2个电子,C的原子核外有三个未成对电子,D原子核外电子排布为nsnnpn+2,E是第四周期元素,最外层只有一个电子,其余各层电子均充满. .
.分析 A、B、C、D、E五种元素,均位于周期表的前四周期,它们的核电荷数依次增加.A元素核内只有质子,则A为H元素;B原子的L层p轨道中有2个电子,核外电子排布式为1s22s22p2,则B为碳元素;D原子核外电子排布为nsnnpn+2,s能级最多容纳2个电子,故n=2,则D为O元素;C的原子核外有三个未成对电子,原子序数介于碳、氧之间,则C为N元素;E是第四周期元素,最外层只有一个电子,其余各层电子均充满,核外电子数为2+8+18+1=29,则E为Cu.
解答 解:A、B、C、D、E五种元素,均位于周期表的前四周期,它们的核电荷数依次增加.A元素核内只有质子,则A为H元素;B原子的L层p轨道中有2个电子,核外电子排布式为1s22s22p2,则B为碳元素;D原子核外电子排布为nsnnpn+2,s能级最多容纳2个电子,故n=2,则D为O元素;C的原子核外有三个未成对电子,原子序数介于碳、氧之间,则C为N元素;E是第四周期元素,最外层只有一个电子,其余各层电子均充满,核外电子数为2+8+18+1=29,则E为Cu.
(1)Cu2+的外围电子排布式为3d9,故答案为:3d9;
(2)A、B、C形成化学式为HCN的分子,该分子中各原子均达到稀有气体稳定结构,则该分子结构式为H-C≡N,分子中碳原子采取的杂化轨道类型为sp杂化,该分子的电子式为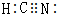 ,
,
故答案为:sp;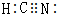 ;
;
(3)同周期随原子序数增大元素第一电离能呈增大趋势,氮元素原子2p轨道为半满稳定状态,能量较大,第一电离能高于同周期相邻元素的,故的第一电离能由大到小的顺序是N>O>C,
故答案为:N>O>C;
(4)①二硫化碳为直线形对称结构,属于非极性分子,故答案为:非极性;
②分子中P原子有1对孤对电子、S原子有2对孤对电子,故每个分子含有10对孤对电子,则0.lmol三硫化四磷分子中含有的孤电子对数为:NA,
故答案为:NA;
(5)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8K,主要原因是:HN3分子之间存在氢键,
故答案为:HN3分子之间存在氢键.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、杂化方式、分子结构与性质、氢键等,注意同周期主族元素第一电离能异常情况、氢键对物质性质的影响.


科目:高中化学 来源: 题型:解答题
| 共价键 | C-C | O=O | C=O |
| 键能/kJ•mol-1 | a | b | c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
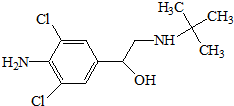 瘦肉精,学名盐酸克伦特罗,该药物既不是兽药,也不是饲料添加剂,而是肾上腺类神经兴奋剂,可以增加动物的瘦肉量.减少饲料使用.使肉品提早上市,降低成本,但对人体会产生副作用,盐酸克伦特罗分子结构简式如图.下列说法不正确的是( )
瘦肉精,学名盐酸克伦特罗,该药物既不是兽药,也不是饲料添加剂,而是肾上腺类神经兴奋剂,可以增加动物的瘦肉量.减少饲料使用.使肉品提早上市,降低成本,但对人体会产生副作用,盐酸克伦特罗分子结构简式如图.下列说法不正确的是( )| A. | 瘦肉精的分子式是C11H18ON2Cl2 | |
| B. | 物质能发生取代反应、氧化反应、加成反应和水解反应 | |
| C. | 1mol盐酸克伦特罗最多能与4molNaOH反应 | |
| D. | 盐酸克伦特罗分子中至少有7个碳原子共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌粒与稀硝酸反应:Zn+2 H+═Zn2++H2↑ | |
| B. | 醋酸与氨水反应:CH3COOH+NH3•H2O═CH3COONH4+H2O | |
| C. | NH4Al(SO4)2与足量NaOH稀溶液反应5OH-+NH4++Al3+═AlO2-+NH3•H2O+2H2O | |
| D. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性按X、Y、Z的顺序递增 | |
| B. | 三种元素的最高价氧化物对应的水化物酸性:H2ZO3>H3YO4>H2XO4 | |
| C. | 元素的最高正化合价按X、Y、Z的顺序递减 | |
| D. | 元素原子的半径按X、Y、Z的顺序递减 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在烧瓶中装约$\frac{1}{3}$体积的自来水,并放入几粒沸石防暴沸 | |
| B. | 若使用温度计须将温度计水银球插到自来水中 | |
| C. | 冷水从冷凝管下口入,上口出 | |
| D. | 收集到的液体取少量滴入硝酸银和稀硝酸,无明显现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com