
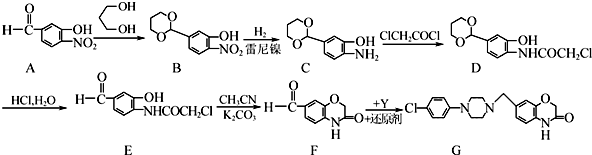
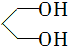 的名称为1,3丙二醇;设计步骤A→B的目的是保护醛基,防止被还原.
的名称为1,3丙二醇;设计步骤A→B的目的是保护醛基,防止被还原. .
.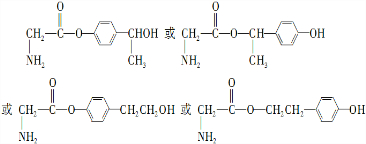 .
.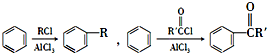
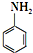 易氧化,酰胺基(
易氧化,酰胺基(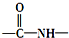 )难以被H2还原.
)难以被H2还原.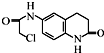 )是合成一种新型口服强心药的中间体,请写出以
)是合成一种新型口服强心药的中间体,请写出以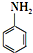 、ClCH2CH2COCl、ClCH2COCl为原料制备Z的合成路线流程图(无机试剂可任选).
、ClCH2CH2COCl、ClCH2COCl为原料制备Z的合成路线流程图(无机试剂可任选).分析 (1)属于二元醇,指明羟基位置进行命名;B中硝基被氢气还原转化为C中氨基,A转化B的目的是保护醛基,防止被还原;
(2)对比E、F的结构可知,E脱去1分子HCl形成F,属于取代反应;
(3)对比F、G的结构,结合Y的分子式为C10H13N2Cl,可知Y的结构简式为 ;
;
(4)同时满足下列条件的C的一种同分异构体:①苯环上有两个取代基,②核磁共振氢谱图中有7个峰,③能发生水解反应,可以含有酯基,产物之一是氨基乙酸,可以含有氨基,另一种产物能与FeCl3溶液发生显色反应,可以含有酚羟基,或者羧酸与酚形成的酯基;
(5)苯胺先与ClCH2CH2COCl发生取代反应生成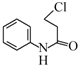 ,然后再氯化铝作用下生成
,然后再氯化铝作用下生成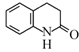 ,发生硝化反应生成
,发生硝化反应生成 ,再发生还原反应生成
,再发生还原反应生成 ,最后与ClCH2COCl发生取代反应生成
,最后与ClCH2COCl发生取代反应生成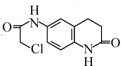 .
.
解答 解:(1)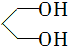 的名称为1,3丙二醇,B中硝基被氢气还原转化为C中氨基,A转化B的目的是保护醛基,防止被还原,
的名称为1,3丙二醇,B中硝基被氢气还原转化为C中氨基,A转化B的目的是保护醛基,防止被还原,
故答案为:1,3丙二醇;保护醛基,防止被还原;
(2)对比E、F的结构可知,E脱去1分子HCl形成F,属于取代反应,
故答案为:取代反应;
(3)对比F、G的结构,结合Y的分子式为C10H13N2Cl,可知Y的结构简式为 ,
,
故答案为: ;
;
(4)同时满足下列条件的C的一种同分异构体:①苯环上有两个取代基,②核磁共振氢谱图中有7个峰,③能发生水解反应,可以含有酯基,产物之一是氨基乙酸,可以含有氨基,另一种产物能与FeCl3溶液发生显色反应,可以含有酚羟基,或者羧酸与酚形成的酯基,符合条件的同分异构体为: ,
,
故答案为: ;
;
(5)苯胺先与ClCH2CH2COCl发生取代反应生成 ,然后再氯化铝作用下生成
,然后再氯化铝作用下生成 ,发生硝化反应生成
,发生硝化反应生成 ,再发生还原反应生成
,再发生还原反应生成 ,最后与ClCH2COCl发生取代反应生成
,最后与ClCH2COCl发生取代反应生成 ,合成路线流程图为:
,合成路线流程图为: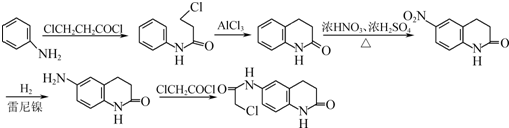 ,
,
故答案为: .
.
点评 本题考查有机物的合成,注意根据转化关系及给予的信息进行合成路线设计,侧重考查学生自学能力、信息获取与迁移运用能力,(4)中同分异构体的书写为易错点、难点,熟练掌握官能团的性质与衍变.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食用蛋白质可以为人体提供氨基酸 | |
| B. | 加碘盐中的碘是I2 | |
| C. | 袋装食品里放置的小袋硅胶是抗氧化剂 | |
| D. | 发酵粉中的小苏打是Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟离子的结构示意图: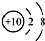 | |
| B. | 次氯酸的结构式:H-Cl-O | |
| C. | 溴化铵的电子式: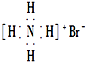 | |
| D. | 质子数为53,中子数为78的碘原子:53131 I |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉中加入浓盐酸:ClO-+Cl-+2H+═Cl2↑+H2O | |
| B. | 氯化铁溶液洗涤银镜:Fe3++Ag═Fe2++Ag+ | |
| C. | 0.1 mol•L-1NH4HSO4溶液和0.1 mol•L-1NaOH等体积混合:NH4++H++2OH-═NH3•H2O+H2O | |
| D. | 0.1 mol•L-1的NaAlO2溶液和0.15 mol•L-1的H2SO4溶液等体积混合:AlO2-+4H+═Al3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
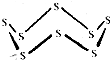 黑火药是我国古代的四大发明之一,KNO3、C及S8 (结构式如图所示)爆炸生成K2S、CO2和N2,下列说法正确的是( )
黑火药是我国古代的四大发明之一,KNO3、C及S8 (结构式如图所示)爆炸生成K2S、CO2和N2,下列说法正确的是( )| A. | 该反应属于置换反应 | |
| B. | 该反应中氧化剂只有KNO3 | |
| C. | 32g S8含有S-S的数目约为6.02×1023 | |
| D. | 1mol KNO3参与该反应,转移电子总数目约为5×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
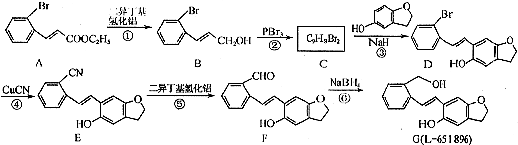
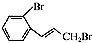 .
. (只写一种).
(只写一种). 为原料制备二氢异苯并呋喃(结构简式如图
为原料制备二氢异苯并呋喃(结构简式如图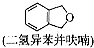 )的合成路线流程图(无机试剂可任选).
)的合成路线流程图(无机试剂可任选).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2%H2O2溶液 | 无 |
| ② | 10mL 5%H2O2溶液 | 无 |
| ③ | 10mL 5%H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5%H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5%H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
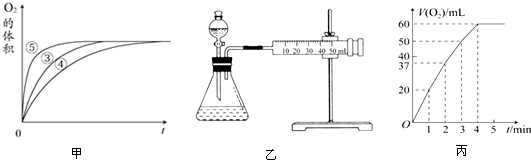
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com