
【题目】卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子的易溶盐。以卤块为原料可制得轻质氧化镁,工艺流程如图:
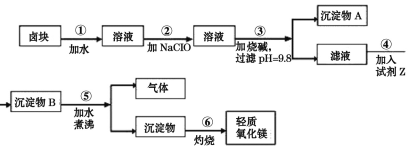
已知:(1)Fe2+氢氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。
(2)原料价格表
物质 | 价格/(元·吨-1) |
漂液(含25.2%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
烧碱(含98%NaOH) | 2100 |
纯碱(含99.5%Na2CO3) | 600 |
(3)生成氢氧化物沉淀的PH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
回答下列问题:
(1)某课外兴趣小组设计实验证明卤块中含有Fe3+为:取少许样品加水溶解,____,则说明卤块中含Fe3+。
(2)工业上冶炼镁常用的方法的化学方程式为____。
(3)步骤②加入NaClO而不用H2O2的原因是____,步骤②反应后产生少量红褐色沉淀,该反应中氧化剂与还原剂的比例为____。
(4)沉淀A的主要成分为____;步骤④加入的物质为____。
(5)步骤⑤发生的反应的化学方程式为____。
(6)步骤⑥如在实验室进行,应选用在____(填仪器名称)中灼烧。
【答案】往所得溶液中滴加硫氰化钾溶液,若溶液变红 MgCl2(熔融)![]() Mg+Cl2↑ 漂液比H2O2的价格低得多 1:2 Fe(OH)3 Mn(OH)2 Na2CO3 MgCO3+H2O
Mg+Cl2↑ 漂液比H2O2的价格低得多 1:2 Fe(OH)3 Mn(OH)2 Na2CO3 MgCO3+H2O![]() Mg(OH)2+CO2↑ 坩埚
Mg(OH)2+CO2↑ 坩埚
【解析】
为除去Fe2+,先将Fe2+氧化成Fe3+,然后加入NaOH调节pH为9.8,然后在滤液中加入纯碱将Mg2+从溶液中以MgCO3沉淀出来,然后加热煮沸可得到Mg(OH)2,灼烧后得到MgO,据此解答。
(1)KSCN与Fe3+作用使溶液显红色,证明卤块中含有Fe3+,可以向溶液中加入硫氰化钾溶液,若溶液变成红色,证明溶液中含有铁离子,否则不含铁离子,所以实验操作为:取样,加水溶解,往所得溶液中滴加硫氰化钾溶液,若溶液变红,则说明卤块中含铁离子;
(2)镁是活泼的金属,一般用电解法冶炼,则工业上冶炼镁常用方法的化学方程式为MgCl2(熔融)![]() Mg+Cl2↑。
Mg+Cl2↑。
(3)步骤②是为了将Fe2+氧化成Fe3+,并在控制合适的pH条件时生成Fe(OH)3沉淀而除之,虽然漂液和H2O2都可采用,但对比表中提供的原料价格可以看出,漂液比H2O2的价格低得多,所以选漂液最合理;步骤②反应后产生少量红褐色沉淀,即亚铁离子被氧化为铁离子,而氧化剂次氯酸钠被还原为氯化钠,反应中铁元素化合价升高1价,氯元素化合价降低2价,所以根据电子得失守恒可知该反应中氧化剂与还原剂的比例为1:2。
(4)根据表中数据可知调节pH=9.8时得到的沉淀A的主要成分为Fe(OH)3、Mn(OH)2;沉淀B是碳酸镁,则步骤④加入的物质为碳酸钠。
(5)步骤④生成的沉淀物是MgCO3,所以步骤⑤中沉淀物MgCO3在煮沸的情况下发生水解,生成Mg(OH)2和CO2气体,反应的化学方程式为MgCO3+H2O![]() Mg(OH)2+CO2↑。
Mg(OH)2+CO2↑。
(6)步骤⑥由氢氧化镁灼烧制备氧化镁,应该在耐高温的坩埚中进行。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】化学科学的形成、发展与应用过程中,下列科学家与其成就不相对应的是
A.1961年英国科学家波义尔提出化学元素的概念
B.1774年法国科学家拉瓦锡提出燃烧的氧化学说
C.1811年意大利科学家阿伏加德罗提出原子学说
D.1943年,科学家侯德榜发明联合制碱法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生存和发展的重要支柱。研究并有效地开发新能源在能源紧缺的今天具有重要的理论意义。已知H2与CO反应生成CH3OH的过程如图所示:
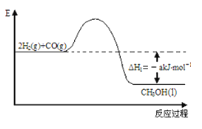
CO的燃烧热△H2=-b kJ/mol,CH3OH的燃烧热△H3=-c kJ/mol。请根据以上信息,回答下列有关问题:
(1)甲醇是一种______(填“可”或“不可”)再生能源,甲醇的官能团的电子式是____________。
(2)CH3OH燃烧热的热化学反应方程式为___________________________________。
(3)H2的燃烧热△H=_______________________。
(4)一些化学键键能如下:C≡O为d kJ/mol;O=O为ekJ/mol;C=O为fkJ/mol。则由以上数据算出b=_______(用d、e、f的代数式表示)。
(5)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH=﹣d kJ/mol,在一定温度下,将1mol CO(g)和2molH2(g)充入到体积为10L的密闭容器中,发生反应。经过5min达到平衡,此时容器内压强为反应前的0.8倍。则此时v逆(CH3OH)为____________,正反应放出的热量为__________________,CO的转化率为___________。
CH3OH(g) ΔH=﹣d kJ/mol,在一定温度下,将1mol CO(g)和2molH2(g)充入到体积为10L的密闭容器中,发生反应。经过5min达到平衡,此时容器内压强为反应前的0.8倍。则此时v逆(CH3OH)为____________,正反应放出的热量为__________________,CO的转化率为___________。
(6)煤燃烧的烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为NO(g)+O3(g)=NO2(g)+O2(g) ΔH=-200.9kJ/mol,NO(g)+1/2O2(g)=NO2(g) ΔH=-58.2kJ/mol,SO2(g)+O3(g)=SO3(g)+O2(g) ΔH=-241.6kJ/mol,反应3NO(g)+O3(g)==3NO2(g)的ΔH=________kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A与B在容积为1 L的密闭容器中发生反应:aA(s)+bB(g)![]() cC(g)+dD(g),t1、t2时刻分别测得部分数据如下表。下列说法正确的是
cC(g)+dD(g),t1、t2时刻分别测得部分数据如下表。下列说法正确的是
n(B)/mol | n(C)/mol | n(D)/mol | 反应时间/min |
0.12 | 0.06 | 0.10 | t1 |
0.06 | 0.12 | 0.20 | t2 |
A. 0~t1时间段内,平均反应速率v(B)=0.04/t1 mol·(L·min)-1
B. 若起始时n(D)=0,则t2时刻v(D)=0.20/t2 mol·(L·min)-1
C. 升高温度,v(B)、v(C)、v(D)均增大
D. b∶d=6∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,甲容器有一个移动活塞,能使容器保持恒压。起始时向甲中充入2 mol SO2、1 mol O2,向乙中充入4mol SO2、2 mol O2。甲、乙的体积都为1L(连通管体积忽略不计).保持相同温度和催化剂存在的条件下,.关闭活塞K,使两容器中各自发生下述反应:2 SO2(g)+O2(g)![]() 2SO3(g)。达平衡时,甲的体积为0.8L。下列说法正确的是
2SO3(g)。达平衡时,甲的体积为0.8L。下列说法正确的是
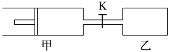
A.乙容器中SO2的转化率小于60%
B.平衡时SO3的体积分数:甲>乙
C.打开K后一段时间.再次达到平衡.甲的体积为1.4 L
D.平衡后向甲中再充入2mol SO2、1mol O2和3moLSO3,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.O2-、F-、Na+、Mg2+半径依次减小
B.O2和O3是氧元素的同素异形体
C.同一元素的不同核素化学性质几乎完全相同
D.同主族元素含氧酸的酸性随核电荷数的增加而减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:3A(g)+B(g)===2C(g)+2D(g),在不同条件下,用不同物质表示其反应速率,分别为①v(A)=0.6 mol·L-1·min-1
②v(B)=0.45 mol·L-1·min-1
③v(C)=0.015 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·min-1,
则此反应在不同条件下进行最快的是( )
A. ②③B. ①③C. ②④D. ②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是常用来衡量一个国家石油化工发展水平的标志性物质,A、B、C、D、E、F、G均为有机物,他们之间有如图转化关系,请回答下列问题:
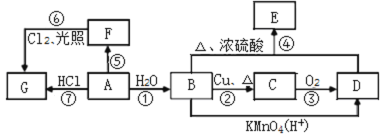
(1)写出A中官能团的名称:A________,B中官能团的电子式B________。
(2)在F的同系物中最简单的有机物的空间构型为________。
(3)写出与F互为同系物的含5个碳原子的所有同分异构体中一氯代物种类最少的物质的结构简式:___________________________________________。
(4)写出下列编号对应反应的化学方程式。
④ _____________________________;⑦ _____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于可逆反应的是( )
A.Cl2与水的反应
B.氮气和氧气的反应
C.电解水生成H2和O2,点燃H2和O2的混合物生成H2O
D.甲烷和氯气光照发生的反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com