
分析 发生N2+3H2=2NH3,焓变等于反应物中键能之和减去生成物中键能之和,结合物质的状态、焓变书写热化学方程式.
解答 解:反应N2(g)+3H2(g)=2NH3(g)的反应热△H=945kJ•mol-1+3×436kJ•mol-1-2×3×391kJ•mol-1=-93kJ•mol-1,故热化学方程式为N2(g)+3H2(g)=2NH3(g)△H=-93kJ•mol-1,
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-93kJ•mol-1.
点评 本题考查反应热与焓变,为高频考点,把握焓变与键能的关系为解答的关键,侧重分析与应用能力的考查,注意物质中化学键数目的判断,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气5mol | |
| B. | 溴水遇到乙醛溶液出现褪色现象,是因为它们发生了氧化反应 | |
| C. | 乙烯与苯都能使溴水褪色,但褪色原理不同 | |
| D. | 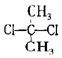 与 与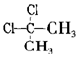 互为同分异构体 互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
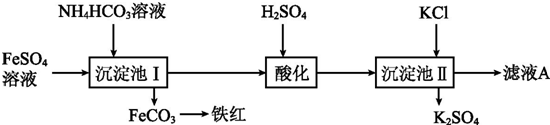
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
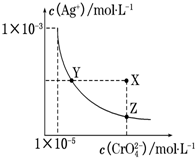 在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示. 又知AgCl的Ksp=1.8×10-10.下列说法正确的是( )
在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示. 又知AgCl的Ksp=1.8×10-10.下列说法正确的是( )| A. | t℃时,Ag2CrO4的Ksp为1×10-8 | |
| B. | 在饱和Ag2CrO4溶液中加入K2CrO4能使溶液由Y点变为X点 | |
| C. | t℃时,Y点和Z点时Ag2CrO4的Ksp相等 | |
| D. | t℃时,将0.01 mol•L-1 AgNO3溶液滴入20 mL 0.01 mol•L-1 KCl和0.01 mol•L-1 K2CrO4的混合溶液中,CrO42-先沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
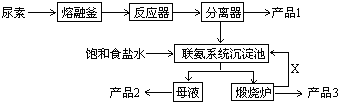
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1mol/L氯化钠溶液 | B. | 5 mL 2mol/L 氯化铵溶液 | ||
| C. | 150 mL 1mol/L氯化钾溶液 | D. | 75 mL 1.5mol/L 氯化镁溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com