
| A. | 氯离子的结构示意图: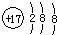 | |
| B. | 作为相对原子质量测定标准的碳核素:${\;}_6^{14}$C | |
| C. | 氯化镁的电子式: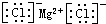 | |
| D. | 乙烯结构简式CH2=CH2 |
分析 A.氯离子的核电荷数为17;
B.作为相对原子质量测定标准的碳核素为C-12;
C.氯化镁属于离子化合物,其电子式需要标出所带电荷,氯离子还需要标出最外层电子;
D.碳碳双键不能省略.
解答 解:A.氯离子的核电荷数为17,核外电子总数为18,最外层达到8电子稳定结构,氯离子正确的结构示意图为: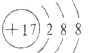 ,故A正确;
,故A正确;
B.C-12是作为相对原子质量测定标准的碳核素,正确表示方法为:612C,故B错误;
C.氯化镁为离子化合物,镁离子直接用离子符号表示,氯离子需要标出最外层电子及所带电荷,氯化镁正确的电子式为: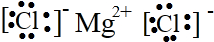 ,故C正确;
,故C正确;
D.碳碳双键不能省略,乙烯结构简式CH2=CH2,故D正确;
故选B.
点评 本题考查了元素符号、离子结构示意图、电子式等化学用语的判断,题目难度中等,注意掌握常见化学用语的概念及表示方法,明确离子化合物与共价化合物电子式的区别,为易错点.


科目:高中化学 来源: 题型:解答题
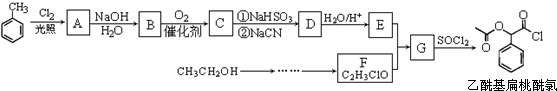
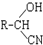 ,RCN$\stackrel{H_{2}O/H+}{→}$RCOOH,RCOOH$\stackrel{SOCl_{2}}{→}$RCOCl$\stackrel{R′OH}{→}$RCOOR′
,RCN$\stackrel{H_{2}O/H+}{→}$RCOOH,RCOOH$\stackrel{SOCl_{2}}{→}$RCOCl$\stackrel{R′OH}{→}$RCOOR′ ,E中含氧官能团的名称醇羟基和羧基.
,E中含氧官能团的名称醇羟基和羧基.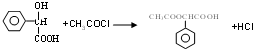 .
.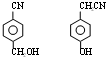 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④②⑤③ | B. | ④①②⑤③ | C. | ②④⑤①③ | D. | ⑤②④①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸钠溶液容易吸收空气中CO2变质而生成硅酸 | |
| B. | Fe与Cl2反应生成FeCl3,Fe与S反应生成FeS | |
| C. | 实验室盛放NaOH溶液时不能使用玻璃塞,应该用橡胶塞 | |
| D. | 加碘食盐能使淀粉溶液变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气.写出该反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气.写出该反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g氧气中所含的氧原子数为NA | |
| B. | 1molCl2与足量H2O反应,转移的电子数为2NA | |
| C. | 标准状况下,22.4L二氧化硅所含有的原子数目为3NA | |
| D. | 钠在氧气中燃烧,1 mol O2作氧化剂时得到的电子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
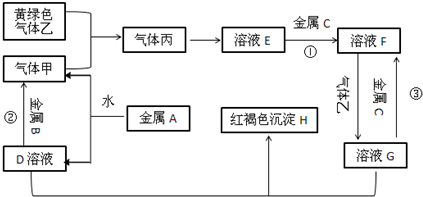
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 浓度/mol•L-1 时间/min | c(CO) | c(H2) | c(CH3OH) |
| 0 | 1.0 | 2.0 | 0 |
| 2 | 0.8 | 0.2 | |
| 4 | 1.0 | 0.5 | |
| 6 | 1.0 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | P H=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com