
| A. | 1mol任何物质都含有6.02×1021个原子, | |
| B. | 0.012kg12C含有6.02×1023碳原子 | |
| C. | 阿伏伽德罗常数表示的粒子“集体”就是1mol | |
| D. | 使用摩尔这一单位时必须指明粒子的名称 |
分析 A.物质有的是单原子分子,有的是双原子分子多原子分子,离子化合物等;
B.根据国际规定1mol任何微粒的集合体含有的微粒数来回答;
C.依据阿伏伽德罗常数的规定分析判断;
D.物质的量是描述微观粒子的物理量,单位为mol;
解答 解:A.构成物质的微粒不同,1 mol任何物质不一定都含有6.02×1023个原子,如:1mol氧气分子中含有2mol氧原子,故A错误;
B.国际规定1mol任何微粒的集合体含有的微粒数和0.012kg12C中约含有的碳原子数目相等都是6.02×1023个,故B正确;
C.国际规定1mol任何微粒含有微粒数目为阿伏伽德罗常数个,所以阿伏伽德罗常数表示的粒子“集体”就是1mol,故C正确;
D.物质的量是描述微观粒子的物理量,单位为mol,使用物质的量需要指明微粒种类,故D正确;
故选:A.
点评 本题考查了物质的量的概念、单位和应用,阿伏伽德罗常数的意义,准确把握概念内涵是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
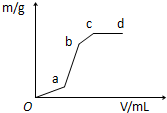 向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入的体积V之间的关系,关于图曲线的推测正确的是( )
向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入的体积V之间的关系,关于图曲线的推测正确的是( )| A. | ab段产生的沉淀为硫酸钡 | |
| B. | ab产生段的沉淀为氢氧化镁 | |
| C. | bc段产生的沉淀为氢氧化镁 | |
| D. | bc段产生的沉淀为硫酸钡和氢氧化镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu与Cu20的物质的量之比为2:1 | |
| B. | 硝酸的物质的量浓度为2.4mol/L | |
| C. | 产生的NO在标准状况下的体枳为4.48L | |
| D. | Cu、Cu20与硝酸反应后剩余HN03为lmol |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 在图中的物质均为中学化学中常见的物质,其中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液呈红色.请问答下列问题:
在图中的物质均为中学化学中常见的物质,其中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液呈红色.请问答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
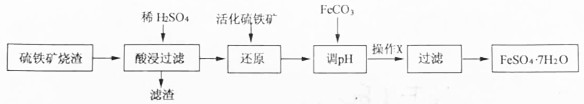
| Fe3+ | Al3+ | Fe2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 4FeS2( s)+11O2( g)═2Fe2O3( s)+8SO2(g)△H=-3414.8kJ•moL | |
| B. | FeS2(s)+$\frac{11}{4}$O2(g)═$\frac{1}{2}$Fe2O3 (s)+2SO2(g)△H=-853.7kJ•moL | |
| C. | 4FeS2(s)+11O2(g)═2 Fe2O3 (s)+8SO2(g)△H+3414.8kJ•moL | |
| D. | FeS2(s)+$\frac{11}{4}$O2(g)═$\frac{1}{2}$Fe2O3 (s)+2SO2(g)△H=+853.7kJ•moL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com