
分析 (1)金属导电与自由电子有关,Cu的原子序数为29,则Cu2+的核外电子为27;
(2)[Cu(NH3)4]SO4晶体中含配离子与硫酸根离子之间的离子键,铜离子提供空轨道、N原子提供孤对电子的配位键.
解答 解:(1)金属铜能导电的原因为铜是金属晶体,由金属阳离子和自由电子构成,自由电子在外加电场的作用下可发生定向移动;Cu2+的核外电子排布式为[Ar]3d9或1s22s22p63s23p63d9,故答案为:铜是金属晶体,由金属阳离子和自由电子构成,自由电子在外加电场的作用下可发生定向移动;[Ar]3d9或1s22s22p63s23p63d9;(2)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通N-H共价键外,还有配离子与硫酸根离子之间的离子键,铜离子提供空轨道、N原子提供孤对电子的配位键,故答案为:离子键;配位键.
点评 本题考查金属导电性、电子排布及化学键,为高频考点,把握金属晶体的性质、电子排布及配位键为解答的关键,侧重分析与应用能力的考查,配位键为解答的难点,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
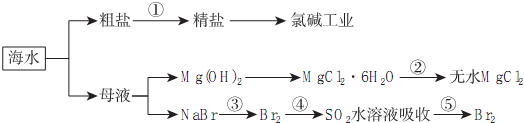
| A. | 除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 在过程④中SO2被氧化 | |
| C. | 从第③步到第⑤步的目的是为了浓缩 | |
| D. | 从能量转换角度看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向20.00mL 0.1mol•L-1的MOH溶液中逐滴加入一定浓度的HA溶液.滴加过程中,溶液的pH与滴入HA溶液的体积关系如图所示,当pH=8时MOH溶液恰好被中和.则下列说法中错误的是( )
常温下,向20.00mL 0.1mol•L-1的MOH溶液中逐滴加入一定浓度的HA溶液.滴加过程中,溶液的pH与滴入HA溶液的体积关系如图所示,当pH=8时MOH溶液恰好被中和.则下列说法中错误的是( )| A. | ②点混合溶液中水电离出的c(H+)大于酸HA溶液中由水电离出的c(H+) | |
| B. | ③点混合溶液中各离子浓度的大小关系是c(M+)=c(A-)>c(H+)=c(OH-) | |
| C. | 酸HA溶液的浓度为0.1 mol•L-1 | |
| D. | ④点溶液中,存在c(HA)+c(H+)>c(M+)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
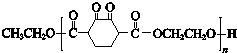 )是人造棉的主要成分之一,合成路线如下:
)是人造棉的主要成分之一,合成路线如下: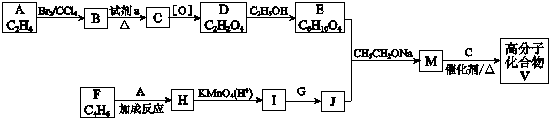
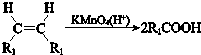
 (R、R1、R2、R3表示烃基)
(R、R1、R2、R3表示烃基)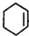 .
.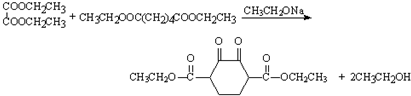 .
.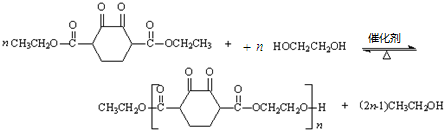 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
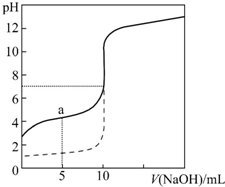 常温下,向等体积、等物质的量浓度的盐酸、醋酸溶液中分别滴入0.1mol•L-1 NaOH溶液,测得溶液的pH与NaOH溶液体积的关系如图所示.下列说法错误的是( )
常温下,向等体积、等物质的量浓度的盐酸、醋酸溶液中分别滴入0.1mol•L-1 NaOH溶液,测得溶液的pH与NaOH溶液体积的关系如图所示.下列说法错误的是( )| A. | 图中虚线表示NaOH溶液滴定盐酸时的pH变化 | |
| B. | 酸溶液的体积均为10 mL | |
| C. | a点:c(CH3COO-)>c(CH3COOH) | |
| D. | 当pH=7时,滴定醋酸消耗的V(NaOH)=10 mL,且c(CH3COO-)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
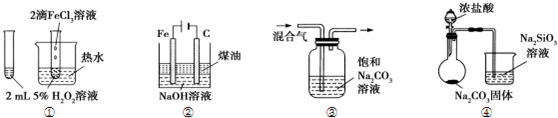
| A. | ①验证FeCl3对H2O2分解反应有催化作用 | |
| B. | ②制备Fe(OH)2并能较长时间观察其颜色 | |
| C. | ③除去CO2气体中混有的SO2 | |
| D. | ④比较HCl、H2CO3和H2SiO3的酸性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFeI2与足量的氯气反应转移电子数为2NA | |
| B. | 标准状况下22.4L一氯甲烷和二氯甲烷的混合物中所含氯原子数介于NA至2NA之间 | |
| C. | 0.1molCu与足量热的浓硫酸反应生成的SO2体积标准状况下约为2.24L | |
| D. | 0.2mol/L的Na2S溶液中,所含S2-数目小于0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “元质”即现代之“元素”,现在人类发现的化学元素多于六十四种 | |
| B. | “养、轻、淡”即“氧、氢、氮”三种元素,现代的元素命名更具科学性 | |
| C. | 上文提到的八种“元质”包括四种金属“元质”和四种非金属“元质” | |
| D. | “微渺”因极其微小,故“微渺”是组成物质的基本微粒,不可再分 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com