
 ;
; ,请写出B元素的单质与氢氧化钠溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
,请写出B元素的单质与氢氧化钠溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.分析 A、B、C三种元素的原子具有相同的电子层数,1molA的单质能跟足量的盐酸反应,在标准状况下可置换出22.4L的H2,A为金属,设A反应后化合价为x,则根据电子转移守恒,1×x=2,解得:x=2,即:A反应后为+2价,这时A转变为与氖原子具有相同电子层结构的离子,则A为镁元素;而B的核电荷数比A大1,则B为铝元素;C原子的电子总数比B原子的电子总数多4,则C为氯元素,结合元素单质、化合物的性质解答该题.
解答 解:A、B、C三种元素的原子具有相同的电子层数,1molA的单质能跟足量的盐酸反应,在标准状况下可置换出22.4L的H2,A为金属,设A反应后化合价为x,则根据电子转移守恒,1×x=2,解得:x=2,即:A反应后为+2价,这时A转变为与氖原子具有相同电子层结构的离子,则A为镁元素;而B的核电荷数比A大1,则B为铝元素;C原子的电子总数比B原子的电子总数多4,则C为氯元素,
(1)用电子式表示氯化镁的形成过程为: ,
,
故答案为: ;
;
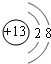
(2)B的离子是铝离子,质子数为13,核外电子数为10,有2个电子层,最外层有8个电子,结构示意图是: ;
;
B的单质为铝,铝与NaOH溶液反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为: ;2Al+2OH-+2H2O=2AlO2-+3H2↑;
;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)与铝离子具有相同电子数的分子中,有一种分子可与盐酸化合生成一种盐,该盐是氯化铵,氯化铵是离子化合物有铵根离子与氯离子构成,含有的化学键为:离子键和共价键,
故答案为:离子键和共价键;
(4)C的单质为氯气,氯气和甲烷发生一元取代反应生成一氯甲烷和氯化氢,反应的化学方程式为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl,
故答案为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl;
(5)A最高价氧化物的水化物为氢氧化镁,C最高价氧化物的水化物为高氯酸,二者反应的离子方程式为:Mg(OH)2+2H+=Mg2++2H2O,
故答案为:Mg(OH)2+2H+=Mg2++2H2O.
点评 本题考查结构性质与位置关系、电子式与离子方程式等化学用语、化学计算等,题目难度中等,根据计算推断A元素是解题关键,是对所学知识的综合考查.


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解)
将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| B. | NH4Cl的电子式: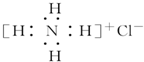 | |
| C. | H、D、T互为同素异形体 | |
| D. | Cl的原子结构示意图: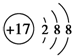 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由Al、Cu、浓硝酸组成的原电池,其负极反应式为:Cu-2e-=Cu2+ | |
| B. | 由Al、Mg、NaOH组成的原电池,其负极反应式为:Al-3e-+3OH-=Al(OH)3↓ | |
| C. | 由Al、Mg、稀硫酸组成的原电池,其负极反应式为:Al-3e-=Al3+ | |
| D. | 由Fe、Cu、FeCl3组成的原电池,其正极反应式为:Cu-2e-=Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 豆浆 | B. | NaCl溶液 | C. | HCl | D. | 空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
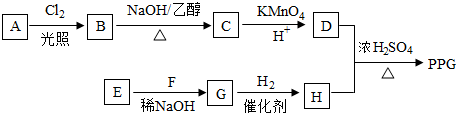
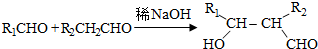
 .
. .
.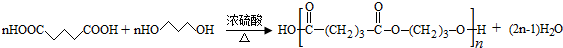 ;
; (写结构简式)
(写结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了便于操作,浓溶液稀释或固体溶解可直接在容量瓶中进行 | |
| B. | 需要95 mL 0.1 mol•L-1 NaCl溶液,可选用100 mL容量瓶来配制 | |
| C. | 用100 mL的量筒量取5.2 mL的盐酸 | |
| D. | 用托盘天平称取25.20 g NaCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com