
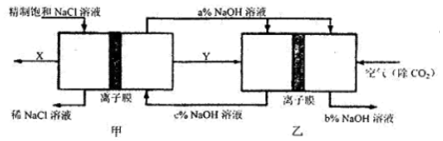
| A. | 甲装置为电解池,其左室为阴极室 | |
| B. | 甲乙两装置中使用的均为阳离子交换膜 | |
| C. | 乙装置为燃料电池,其左室反应为H2-2e-═2H+ | |
| D. | 图中三种NaOH溶液的质量分数关系为b%>c%>a% |
分析 A、甲装置为电解池,其右室产生的氢氧化钠循环利用,所以是氢离子在阴极放电,所以右室为阴极室;
B、甲装置中阳离子不能自由通过交换膜,但钠离子可以自由通过;乙中左室氢气放电生成氢离子结合氢氧根离子生成水,而右室是氧气放电生成氢氧根离子;
C、乙装置为燃料电池,其左室反应为电极反应式为H2-2e-+2OH-=2H2O;
D、燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即a%小于c%,可知NaOH浓度增大.
解答 解:A、甲装置为电解池,其右室产生的氢氧化钠循环利用,所以是氢离子在阴极放电,所以右室为阴极室,而不是左室,故A错误;
B、甲装置中阳离子不能自由通过交换膜,但钠离子可以自由通过;乙中左室氢气放电生成氢离子结合氢氧根离子生成水,而右室是氧气放电生成氢氧根离子,而左室的氢氧根离子的物质的量减小,则钠离子通过交换膜进入右室与产生的氢氧根离子结合成氢氧化钠,所以甲乙两装置中使用的均为阳离子交换膜,故B正确;
C、乙装置为燃料电池,其左室反应为电极反应式为H2-2e-+2OH-=2H2O,而不是产生氢离子,故C错误;
D、燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即a%大于b%,负极氢气失电子生成氢离子消耗氢氧根离子,所以c%>a%,得到c%>a%>b%,故D错误;
故选B.
点评 本题考查原电池与电解池,明确电极的判断及发生的电极反应为解答的关键,注意利用电子守恒进行计算,注重基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用100mL量筒量取5.2mL的稀硫酸 | |
| B. | 用500mL容量瓶配制480mL 0.2mol/L的NaOH溶液 | |
| C. | 用托盘天平称量11.75克NaCl晶体 | |
| D. | 用分液漏斗进行固体和液体的分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色 | |
| B. | 苯酚能跟NaOH溶液反应,而乙醇不能与NaOH溶液反应 | |
| C. | 苯与硝酸在加热的条件生成硝基苯,而甲苯在加热条件下与硝酸发生反应生成三硝基甲苯 | |
| D. | 乙炔能发生加成,乙烷不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuO→Cu2O | B. | H2SiO3→SiO2 | C. | Cu→Cu2(OH)2CO3 | D. | Cu→Cu(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  制取金属锰 | |
| B. |  制取二氧化碳 | |
| C. |  蒸发饱和食盐水制取食盐晶体 | |
| D. |  验证FeCl3对H2O2分解反应有催化作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的△H=2×(-57.3)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com