
分析 (1)高锰酸钾有强氧化性,作氧化剂,K2C2O4中C的化合价为+3价,CO2中C的化合价为+4价,K2C2O4作还原剂,由高锰酸钾生成硫酸锰Mn元素化合价降低5,据氧化还原反应中电子得失守恒,再结合反应前后元素守恒配平化学方程式;
(2)草酸为二元弱酸,则其一级电离中电离出草酸氢根离子和氢离子;
(3)滴定结束前溶液为无色,滴定结束后高锰酸根离子过量,则溶液变为浅红色,据此判断滴定终点;
(4)根据步骤a、b中数据可计算出250mL样品溶液中含有的铁离子、草酸根离子的物质的量,然后根据电荷守恒计算出钾离子的物质的量;再根据总质量计算出样品中含有水的质量、物质的量,最后确定该化合物的化学式.
解答 解:(1)该反应中化合价的变化为:KMnO4→MnSO4,Mn元素由+7价→+2价,一个KMnO4分子得5个电子;K2C2O4→CO2,C元素由+3价→+4价,一个K2C2O4失去2个电子,所以得失电子的最小公倍数为10,所以KMnO4的计量数为2,K2C2O4的计量数为5,其它元素根据原子守恒配平化学方程式为.2KMnO4+5H2C2O4+3H2SO4=2MnSO4+1K2SO4+10CO2+8H2O;
故答案为:2、5、3、2、1、10、8;
(2)草酸(H2C2O4)为二元弱酸,其一级电离的方程式为:H2C2O4?HC2O4-+H+;
故答案为:H2C2O4?HC2O4-+H+;
(3)用0.050mol•L-1KMnO4溶液滴定草酸溶液,滴定结束前溶液为无色,结束后溶液会变为浅红色,则滴定终点的现象为:最后1滴KMnO4溶液滴入后,溶液变为浅红色,且半分钟内不变色,
故答案为:最后1滴KMnO4溶液滴入后,溶液变为浅红色,且半分钟内不变色;
(4)步骤a中高温灼烧至质量不再改变,称量出的0.08g固体为Fe2O3,
则在250 mL溶液中,n(Fe3+)=2n(Fe2O3)=$\frac{0.08g}{160g/mol}$×$\frac{250mL}{25mL}$=0.01 mol,
步骤b中,根据反应2KMnO4+5H2C2O4+3H2SO4═2MnSO4+K2SO4+10CO2+8H2O可知,250mL待测液中:n(C2O42-)=n(KMnO4)×$\frac{5}{2}$×$\frac{250mL}{25mL}$=0.050mol/L×24.00×10-3L×$\frac{5}{2}$×10=0.03 mol,
根据电荷守恒n(K+)+3n(Fe3+)=2n(C2O42-)可得:n(K+)=0.03 mol,
样品中含有水的质量为:m(H2O)=(4.91g-39g•mol-1×0.03mol-56g•mol-1×0.01mol-88g•mol-1×0.03mol)=0.54g,水的物质的量为:n(H2O)=$\frac{0.54g}{18g/mol}$=0.03 mol,
故化合物KaFeb(C2O4)c•dH2O中:n(K+):n(Fe3+):n(C2O42-):n(H2O)=3:1:3:3,
所以该化合物的化学式为:K3Fe(C2O4)3•3H2O,
答:该化合物的化学式为K3Fe(C2O4)3•3H2O.
点评 本题考查了探究物质组成、测量物质含量的方法,题目难度中等,涉及弱电解质的电离方程式书写、中和滴定操作方法及化学计算,注意掌握质量守恒定律、电荷守恒在化学计算中的应用方法,试题培养了学生的分析能力及化学实验、化学计算能力.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1稀硫酸中含有硫酸根个数为0.1NA | |
| B. | 标准状况下,0.5NA氟化氢分子所占体积是11.2L | |
| C. | 2.4g金属镁与足量的盐酸反应,生成氢气的体积为2.24L | |
| D. | 12.4g白磷中含有磷原子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将饱和FeCl3溶液滴入沸水中制备胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| B. | 用FeS去除废水中的Hg2+:Hg2++S2-═HgS↓ | |
| C. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | KHS溶液中HS-的电离:HS-+H2O?H3O++S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
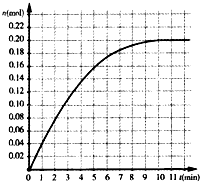 恒温条件下,往容积为2L的密闭容器内加入0.4mol的N2和1.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g),反应中NH3物质的量变化情况如图:下列说法不合理的是( )
恒温条件下,往容积为2L的密闭容器内加入0.4mol的N2和1.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g),反应中NH3物质的量变化情况如图:下列说法不合理的是( )| A. | 其它条件不变,若改用5L容器达到平衡需要的时间将大于10min | |
| B. | N2平衡转化率为25% | |
| C. | 平衡时气体总压强为开始时的90% | |
| D. | 反应前10min反应速率v(H2)=0.01mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积、等物质的量浓度的强酸中所含的H+数目一定相等 | |
| B. | 1L二氧化碳气体一定比1L氧气的质量大 | |
| C. | 同温同压下,相同体积的物质,它们的物质的量必定相等 | |
| D. | 任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化氢是由氢气和氧气组成的 | |
| B. | 它是由2个氢元素和2个氧元素组成的 | |
| C. | 过氧化氢在二氧化锰作用下能生成水和氧气,该反应为复分解反应 | |
| D. | 每个过氧化氢分子中含有2个氢原子和2个氧原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com